
 ����̼ѭ��������ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�
����̼ѭ��������ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�| ʵ���� | �¶�/�� | ��ʼ����mol�� | ƽ������mol�� | �ﵽƽ���� ��Ҫʱ��/min | ||
| CO��g�� | H2O��g�� | CO2��g�� | H2��g�� | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
���� I����Ӧ��C��CO2��̼Ԫ�ػ��ϼ���0������Ϊ+4�ۣ�������4�ۣ�KMnO4��MnSO4��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ20����C��ϵ��Ϊ5����KMnO4ϵ��Ϊ4�����ԭ���غ���ƽ��ʽ��
��1������v=$\frac{��c}{��t}$����v��H2��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��CO2����
��2����Ӧ�ﵽƽ��״̬ʱ��ͬ�����ʵ������淴Ӧ������ȣ�ƽ��ʱ����ֵ����ʵ�����Ũ�ȡ������Ȳ��ٷ����仯���Լ��ɴ����������������䣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��3��II��IIIΪͬ���µķ�Ӧ��III�൱����II�Ļ����������˷�Ӧ���Ũ�ȣ�ѹǿ����һ������ѹǿ����ƽ�ⲻ�ƶ�����Ӧ��ת���ʲ��䣻
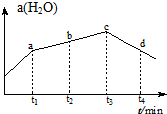
��4����ͼ��֪��c��ת������ߣ�����ƽ��״̬�����������¶�ƽ�������ƶ���c��֮ǰ��δ����ƽ��״̬����Ӧ������Ӧ���У�
��� �⣺I����Ӧ��C��CO2��̼Ԫ�ػ��ϼ���0������Ϊ+4�ۣ�������4�ۣ�KMnO4��MnSO4��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ20����C��ϵ��Ϊ5����KMnO4ϵ��Ϊ4�����ԭ���غ���ƽ��ʽΪ��5C+4KMnO4+6H2SO4=5CO2��+4MnSO4+2K2SO4+6H2O��
�ʴ�Ϊ��5��4��5��4��2��
��1��v��H2��=$\frac{\frac{1mol}{2L}}{5min}$=0.1mol•��L•min��-1������֮�ȵ��ڻ�ѧ������֮����v��CO2��=v��H2��=0.1mol•��L•min��-1���ʴ�Ϊ��0.1��
��2��A����Ӧǰ����������ʵ����������仯��������ʼ��ѹǿ���䣬����˵����Ӧ����ƽ�⣬��A����
B�� ���������Ϊ2L����ʼŨ��=1mol/L
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����1 1 0 0
ת����mol/L����0.5 0.5 0.5 0.5
ƽ�⣨mol/L����0.5 0.5 0.5 0.5
800��ƽ�ⳣ��K=$\frac{0.5��0.5}{0.5��0.5}$=1����$\frac{c��C{O}_{2}��•c��{H}_{2}��}{c��CO��•c��{H}_{2}O��}$=2��K=1����Ӧ���淴Ӧ���У���B����
C������������䣬������������䣬���ܶ�ʼ�ղ��䣬���ܶȲ��䲻��˵���ﵽƽ�⣬��C����
D���ɷ���ʽ��֪������CO��=������CO2�������ڦ�����CO��=������CO2�����ʦ�����CO��=������CO������Ӧ����ƽ�⣬��D��ȷ��
��ѡ��D��
��3��II��IIIΪͬ���µķ�Ӧ��III�൱����II�Ļ����������˷�Ӧ���Ũ�ȣ�ѹǿ����һ������ѹǿ����ƽ�ⲻ�ƶ�����Ӧ��ת���ʲ��䣬��y=2��0.5=1��
�ʴ�Ϊ��1��
��4����ͼ��֪��c��ת������ߣ�����ƽ��״̬�����������¶�ƽ�������ƶ���c��֮ǰ��δ����ƽ��״̬����Ӧ������Ӧ���У���b�������������
�ʴ�Ϊ������
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ��״̬�жϡ�������ԭ��Ӧ��ƽ�ȣ�II�У�3��ע�����õ�Ч˼����з�������Ѷ��еȣ�


 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ijѧϰС�����Ҵ���������Ϊԭ���Ʊ������飮
��ijѧϰС�����Ҵ���������Ϊԭ���Ʊ������飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʱ��/s | 0 | 1 | 2 | 3 | 4 |
| c��SO2��/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00��10-37 | 3.00��10-37 |
| c��CO��/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A�� | ��v��SO2����=2v��CO����ʱ���÷�Ӧ�ﵽ��ƽ��״̬ | |
| B�� | X�Ļ�ѧʽΪCO2 | |
| C�� | ǰ1s��v��X��=1.00mol•L-1•s-1 | |
| D�� | ������Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʱ��/s | 0 | 500 | 100��0 | 150��0 |
| c��N2O5��/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A�� | T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1��T2����K1��K2 | |
| B�� | 500s��N2O5�ֽ�����Ϊ2.96��10-3mol•L-1•s-1 | |
| C�� | ��ƽ��������������䣬�����������ѹ����ԭ���� $\frac{1}{2}$����c��N2O5����5.00mol•L-1 | |
| D�� | T1�¶��µ�ƽ�ⳣ��ΪK1=125��ƽ��ʱN2O5��ת����Ϊ50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������ͭ������ȡ����ͭ��Ȼ��������ȡ������ͭ��������ʹ����طֽ���ȡ�����ģ��ش��������⣺
��������ͭ������ȡ����ͭ��Ȼ��������ȡ������ͭ��������ʹ����طֽ���ȡ�����ģ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4HCO3 | B�� | Na2SiO3 | C�� | Na2CO3 | D�� | Al2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com