
关于下列各装置图的叙述中,不正确的是 ( )。

A.装置①可验证HCl气体在水中的溶解性
B.装置②可用于收集H2、NH 3、Cl2、HCl、NO2、NO等
3、Cl2、HCl、NO2、NO等
C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
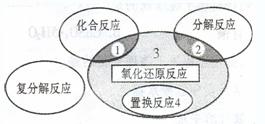
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的( )
A.4Fe(0H)2+O2+2H2O  4Fe(OH)3
4Fe(OH)3
B.2NaHCO3  Na2CO3+H2 O+CO2↑
Na2CO3+H2 O+CO2↑
C.4NH3+5O2  4NO+6H2O
4NO+6H2O
D.Zn+H2SO4  ZnSO4+H2 ↑
ZnSO4+H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111[ | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 ▲ 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ▲ ;不宜用盐酸的原因是 ▲ 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 ▲ 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 ▲ 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
 Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 ▲ 。
②达到滴定终点的标志为 ▲ 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 ▲ 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其原因可能为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应
2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,能达到实验目的的是 ( )。
A.瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B.从B口进气,用排空气法收集CO2
C.瓶中盛满水,从B口进气,用排水法收集NO2
D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量 生成H2的体积

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是
| ||||||||||||||||||||||||||||||||||||
|
|
| ||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2 + 4OH- - 4e- = 4H2O;O2 + 2H2O + 4e- = 4OH-。据此作出判断,下列说法中错误的是:
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2+O2=2H2O
C.产物为无污染的水,属于环境友好电池
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
⑴ 160 g/L NaOH溶液的物质的量浓度为 。
⑵ 发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
⑶ 吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
⑷ 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
⑸ 吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
⑹ 从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com