
【题目】卤族元素包括F、Cl、Br 、I等。
(1)基态Br原子的核外电子排布式为[Ar]_________,其价电子层成对与未成对电子个数比为_______。
(2)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是________。


(3)BCl3中心原子的杂化方式为________,NCl3分子的空间构型为 ;第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
【答案】(1)3d104s23p5 6:1
(2)a
(3)sp2 三角锥形 Be、C、O
【解析】
试题分析:(1)Br的原子序数是35,则根据核外电子排布规律可知基态Br原子的核外电子排布式为[Ar] 3d104s23p5,因此其价电子层成对与未成对电子个数比为6:1;
(2)a.同一主族中,元素的电负性随着原子序数的增大而减小,所以从氟到溴,其电负性逐渐减小,a正确;b.氟元素没有正化合价,第VIIA族氯、溴元素的最高化合价数值等于其族序数,b错误;c.第VIIA族元素氢化物的沸点随着相对分子质量的增大而增大,但HF分子间能形成氢键,氢键属于特殊的分子间作用力,强度大于分子间作用力,沸点最高,c错误;d.由于卤族元素的单质均属于分子晶体,随相对分子质量增大范德华力增大,因而沸点逐渐升高,d错误;答案选a;
(3)BCl3中心原子的价层电子对数=![]() ,因此是平面形结构,其杂化方式为sp2;NCl3中心原子的价层电子对数=
,因此是平面形结构,其杂化方式为sp2;NCl3中心原子的价层电子对数=![]() ,因此分子的空间构型为三角锥形;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。
,因此分子的空间构型为三角锥形;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
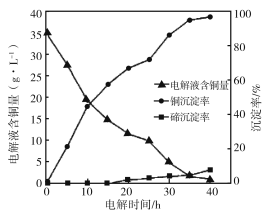
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O
CaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是_____________。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2 ![]() I2
I2 ![]() S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L-1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
A.金属铝均剩余
B.金属铝均溶解
C.盐酸中铝剩余,而氢氧化钠中铝全部溶解
D.氢氧化钠这铝剩余,而盐酸中铝全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【岳阳市一中2010届高三第四次质检考试】下列说法不正确的是( )
A.根据溶液中c(H+)和c(OH-)的相对大小可以判断溶液的酸碱性
B.根据溶液的导电能力大小可以判断电解质的强弱
C.根据熵变和焓变可以判断化学反应能否自发进行
D.根据化学平衡常数可以判断化学反应进行的限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验室制取蒸馏水的实验装置与操作的说法中,不正确的是( )
A.温度计的水银球应插入蒸馏烧瓶内的自来水中
B.冷凝管中的水流方向是从下口进入,上口排出
C.实验中需要在蒸馏烧瓶中加入几片碎瓷片,防止出现暴沸现象
D.蒸馏烧瓶必须垫石棉网加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的CO2 分别通入:①CaCl2 溶液 ②NaAlO2 溶液 ③Ca(OH)2 溶液 ④饱和Na2CO3 溶液。最终溶液中有白色沉淀析出的是
A. ①③ B. ②④ C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值。下列有关叙述正确的是
A.12g由![]() C60和
C60和![]() C60组成的固体中的原子数为NA
C60组成的固体中的原子数为NA
B.4.4g由CO2和N2O组成的混合气体中的电子数为2.2NA
C.常温常压下22.4LNH3中所含的共价键数为3NA
D.1L1mol·L-1次氯酸溶液中的ClO-数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com