
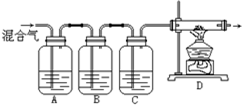
 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.| A | B | C | D | |
| 应加试剂 | ||||
| 所除杂质 |
| A | B | C | D | |
| 应加试剂 | 高锰酸钾溶液 | 氢氧化钠溶液 | 浓硫酸 | 铁粉 |
| 所除杂质 | 乙烯、硫化氢 | 二氧化碳 | 水蒸气 | 氧气 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别配成溶液,再通入CO2 |
| B、分别配成溶液,再加入Ca(OH)2溶液 |
| C、分别加热,用澄清石灰水检验是否有气体产生 |
| D、分别配成溶液,再进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两清夜混合,AgCl和AgI都沉淀 |
| B、向AgCl清夜加入AgNO3固体,c(Ag+)增大,Ksp(AgCl)也增大 |
| C、若AgNO3固体足量,AgCl和AgI都可沉淀,但以AgCl沉淀为主 |
| D、若取0.235克AgI固体放入100ml(忽略体积变化),c(I-)=0.01mol/l |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com