
【题目】根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是( )
晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
A.AlCl3为离子晶体
B.MgCl2为离子晶体
C.SiCl4是分子晶体
D.单质R可能是原子晶体
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
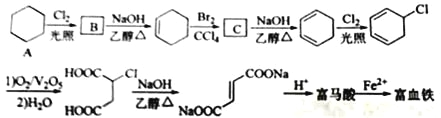
回答下列问题:
(1)A的化学名称为_____;由A生成B的反应类型为_____。
(2)C的结构简式为_____。
(3)富马酸的结构简式为_____。
(4)检验富血铁中是否含有Fe3+的实验操作步骤是_____。
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出____L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有____________(写出结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是 。 (2)混合气体的平均摩尔质量是 。
(3)CO2和CO的体积之比是 。 (4)CO的体积分数是 。
(5)CO2和CO的质量之比是 。 (6)CO的质量分数是 。
(7)混合气体中所含氧原子的物质的量是 。
(8)混合气体中所含碳原子的物质的量是 。
(Ⅱ)(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是 ,原子数之比是 ,质量之比是 ,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是 ;含有原子数最多的
是 ;标准状况下体积最大的是 。
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是 (用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.根据不同的分类标准,可将盐酸归类为纯净物、一元酸、强电解质
B.糖类、油脂、蛋白质都属于天然高分子化合物
C.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸
D.物质的分解、水解、裂解、电解均属于常见的化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的化学反应方程式,并判断其反应类型。
①乙烯和水反应: ,属于 反应;
②由苯制取溴苯: ,属于 反应;
(2)已知一些共价键的键能如下(单位:kJ·mol-1)
H—H 436.4 Cl—Cl 242.7 H—Cl 431.8
①写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式: 。
②若有1g氢气在氯气中完全燃烧,可放出热量 kJ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
B.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C.利用油脂在碱性条件下的水解,可以制甘油和肥皂
D.植物油和矿物油都不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
回答下列问题:
(1)已知:H2和CH3OH的燃烧热分别为-285.8kJ·mol-1,-726.51kJ·mol-1;以及H2O(l)=H2O(g) △H=+44kJ·mol-1;则该反应的△H=________________;
(2)该反应的平衡常数表达式为________________;
(3)在350℃时,体积为0.5L的密闭容器中,充入1molCO2和3molH2发生上述反应,测定出CH3OH的体积分数随时间变化的曲线如图所示:

①能判断该反应达到化学平衡状态的依据是__________________;
A.容器内压强不变 B.H2的体积分数不变 C.c(CH3OH)=c(H2O) D.容器内密度不变
②氢气在0~10min的平衡反应速率v(H2)=_________________________;
③在右图中标出400℃时CH3OH的体积分数随时间变化的曲线。
(4)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气。试回答下列问题:

①这种电池放电时,b处通入______________,发生的电极反应方程式是_____________________。
②若电解液中的3molH+通过质子交换膜,则消耗甲醇__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(谢元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种气体组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com