
【题目】CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
回答下列问题:
(1)已知:H2和CH3OH的燃烧热分别为-285.8kJ·mol-1,-726.51kJ·mol-1;以及H2O(l)=H2O(g) △H=+44kJ·mol-1;则该反应的△H=________________;
(2)该反应的平衡常数表达式为________________;
(3)在350℃时,体积为0.5L的密闭容器中,充入1molCO2和3molH2发生上述反应,测定出CH3OH的体积分数随时间变化的曲线如图所示:

①能判断该反应达到化学平衡状态的依据是__________________;
A.容器内压强不变 B.H2的体积分数不变 C.c(CH3OH)=c(H2O) D.容器内密度不变
②氢气在0~10min的平衡反应速率v(H2)=_________________________;
③在右图中标出400℃时CH3OH的体积分数随时间变化的曲线。
(4)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气。试回答下列问题:

①这种电池放电时,b处通入______________,发生的电极反应方程式是_____________________。
②若电解液中的3molH+通过质子交换膜,则消耗甲醇__________L(标准状况)。
【答案】
(1)CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-86.89 kJmol-1
(2) K=![]()
(3)①AB ② 0.45mol/(L·min) ③ 
(4)① 空气 O2+4e-+4H+=2H2O ②11.2
【解析】
试题分析:(1)由H2(g)的燃烧热△H为-285.8kJmol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;②CH3OH(l)+
O2(g)=H2O(l)△H=-285.8kJmol-1;②CH3OH(l)+ ![]() O2(g)=CO2(g)+2 H2O(l)△H=-726.51kJmol-1,③H2O(l)=H2O(g) △H=+44kJ·mol-1;由盖斯定律可知,3×①-②+③得CO2(g)+3H2(g)=CH3OH(l)+H2O(g)△H=-86.89 kJmol-1;
O2(g)=CO2(g)+2 H2O(l)△H=-726.51kJmol-1,③H2O(l)=H2O(g) △H=+44kJ·mol-1;由盖斯定律可知,3×①-②+③得CO2(g)+3H2(g)=CH3OH(l)+H2O(g)△H=-86.89 kJmol-1;
(2)该反应的平衡常数表达式K=![]() ;
;
(3)①A.反应体系两边系数不等,反应进行的过程中气体的物质的量总和不断变化,则容器内压强不变,说明气体总物质的量不变,是平衡状态,故A正确;B.反应体积中H2的体积分数不变,反应达到平衡状态,故B正确;C.随着反应的进行c(CH3OH)=c(H2O)始终成立,故不一定是平衡状态,故C错误;D.密度等于质量除去体积,质量和体积始终是定值,则容器内密度不变不一定是平衡状态,故D错误;答案为AB。
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量(mol) 1 3 0 0
变化物质的量(mol) x 3x x x
平衡物质的量(mol) 1-x 3-3x x x
平衡时CH3OH的体积分数为![]() ×100%=30%,解得x=0.75,氢气在0~10min的平衡反应速率v(H2)=
×100%=30%,解得x=0.75,氢气在0~10min的平衡反应速率v(H2)=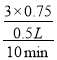 =0.45mol/(L·min);
=0.45mol/(L·min);
③CO2(g)+3H2(g)=CH3OH(l)+H2O(l) △H=-86.89 kJmol-1 是放热反应,升高温度平衡逆向移动,达到新平衡时CH3OH的体积分数减小,但达到平衡需要的时间缩短了,具体如图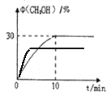 ;
;
(4)①原电池工作时电子由负极经外电路流向正极,H+向正极移动,负极发生氧化反应,正极发生还原反应,由b处通入的为空气,发生的电极反应方程式为O2+4e-+4H+=2H2O;
②若电解液中的3molH+通过质子交换膜,则转移电子的物质的量为3mol,被氧化的甲醇的物质的量![]() =0.5mol,标准状况下体积为22.4L/mol×0.5mol=11.2L。
=0.5mol,标准状况下体积为22.4L/mol×0.5mol=11.2L。


科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl。为减缓铁的腐蚀:

①若X为碳棒,开关K应置于 (填字母,下同)处,②若X为锌, 开关K应置于 处。
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有地铁、城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质均为NaCl溶液)。

你认为其中能合理模拟金属管道的腐蚀原理的是 ;图c中的总反应方程式是 ;
Ⅱ.1 L某溶液中含有的离子如下表:

用惰性电极电解该溶液,当电路中有5 mol e-通过时,溶液的c(H+)= mol/L (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。

据此,请回答下列问题:
(1)写出以下物质的化学式:A ,D ,F 。
(2)写出下列变化的化学方程式:E→C 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是( )
晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
A.AlCl3为离子晶体
B.MgCl2为离子晶体
C.SiCl4是分子晶体
D.单质R可能是原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.卤代烃中卤原子的检验:先加NaOH溶液,加热,冷却后加AgNO3溶液
B.除去乙烷中混有的乙烯,可用酸性KMnO4溶液洗气
C.碳原子数小于10,且一氯代物只有一种的烷烃有3种
D.可用水鉴别苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届雅安三诊】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的右图装置(夹持仪器未画出)进行定性实验。

请回答下列问题:
(1)假设2中的沉淀为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的____ __。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设______(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的相互作用依次是( )
A.氢键;分子间作用力;非极性键
B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物蒸气,完全燃烧时需要两倍于其体积的氧气,产生两倍于其体积的二氧化碳,该有机物可能是( )
A. CH4 B. C2H5OH C. CH3CHO D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学做如下实验,以检验反应中的能量变化。

实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;
(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2) 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空): 能设计成原电池的反应是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com