
【题目】铅镍蓄电池又称爱迪生电池,放电时的总反应为:![]() 下列有关该电池的说法不正确的是( )
下列有关该电池的说法不正确的是( )
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O
【答案】C
【解析】分析:根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,生成Ni(OH)2,充电是放电的逆反应,据此解答。
详解:A、反应后产物有氢氧化物,可得电解液为碱性溶液,由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,A正确;
B、根据总反Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,负极反应为:Fe+2OH--2e-=Fe(OH)2,B正确;
C、充电可以看作是放电的逆过程,即阴极为原来的负极,电池放电时负极反应为:Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,因此电池充电过程中阴极附近溶液的pH会升高,C错误;
D、充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:C(s)+CO2(g)=2CO(g),下列说法不正确的是
A. 将碳块磨成粉末可以加快反应速率
B. 升高温度可以加快反应速率
C. 容器体积不变时,向其中充入N2,反应速率不变
D. 增加碳的质量可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
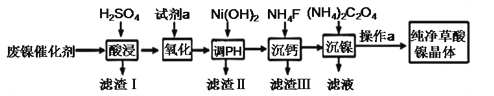
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH4的二氯代物只有一种,此事实可说明CH4为正四面体结构
B.光照条件下,1 mol甲烷和氯气完全取代需要2 mol氯气
C.C6H14的同分异构体有4种
D.正戊烷和异戊烷属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列广告用语在科学性上错误的是( )
A.没有水就没有生命
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素
D.这种饮料不含任何化学物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是
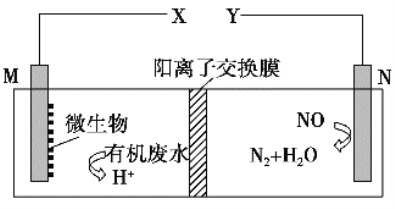
A. 质子透过阳离子交换膜由右向左移动
B. 与X相连接是用电器标有“+”的接线柱
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素,那么,牛和草体内的各种化学元素( )
A. 种类差异很大,含量大体相同
B. 种类和含量差异都很大
C. 种类和含量都是大体相同的
D. 种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要的作用,碳原子本身的化学性质,是它能够通过化学键连接成链或环,从而形成各种生物大分子。可以说,地球上的生命处在碳元素的基础上建立起来的。以上事实可以说明
A. 碳元素组成各种各样的化合物 B. 碳元素是生命的最基本元素
C. 碳元素是各种大分子中含里最多的元素 D. 碳元聚比其他元素重耍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
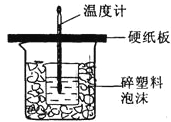
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”)。所求中和热__________(填“相等、不相等”)。简述理由__________________________________________________。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________(填“偏大”、“偏小”、“无影响”)。
(5)利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-42.3kJ·mol-1
甲烷和水蒸气生成二氧化碳和氢气的热化学方程式_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com