
【题目】某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是
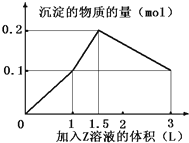
A. 偏铝酸钠、氯化钡、硫酸 B. 偏铝酸钠、氢氧化钡、硫酸
C. 氯化铝、氯化铁、氢氧化钠 D. 氯化铝、氯化镁、氢氧化钠
【答案】B
【解析】A、发生的反应是AlO2-+H++H2O=Al(OH)3↓、Ba2++SO42-=BaSO4↓、Al(OH)3+3H+=Al3++3H2O,全部生成氢氧化铝0.1mol,需要硫酸0.05mol,生成沉淀BaSO40.05mol,需要消耗硫酸0.05mol,因此生成0.1mol沉淀时消耗硫酸的体积为0.5L,故第一段直线不符合,故A错误;B、发生的反应是OH-+H+=H2O、Ba2++SO42-=BaSO4↓、H++AlO2-+H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,图中第一段直线:氢氧化钡中的OH-和硫酸中H+1:1中和,同时Ba2+和SO42-按照1:1反应生成硫酸钡沉淀,发生的反应是Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,图中第二段直线,氢氧化钡消耗完,硫酸继续滴加,H+与AlO2-反应:H++AlO2-+H2O=Al(OH)3↓,硫酸的消耗量和沉淀生成量是1:2,图中第三段直线:硫酸进一步过量,发生Al(OH)3+3H+=Al3++3H2O,硫酸和沉淀消耗量是1.5:1,直到氢氧化铝完全溶解,沉淀只剩下BaSO4,以上三段符合图像的数值变化,故B正确;C、滴入氢氧化钠,发生Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,n(Al3+):n(OH-)=1:3,n(Fe3+):n(OH-)=1:3,继续滴加氢氧化钠,发生Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)1:1,不符合图像的数值变化,故C错误;D、滴入氢氧化钠:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,n(Mg2+):n(OH-)=1:2,n(Al3+):n(OH-)=1:3,继续滴入NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,不符合图像的数值变化,故D错误。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列有关化合物的叙述中正确的是
A.在共价化合物分子中一定同时存在σ键和π键
B.离子化合物的熔点一定比共价化合物的高
C.全由非金属元素组成的化合物一定是共价化合物
D.含有阳离子的化合物一定含有阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4Al2(SO4)32Al2O36H2O,还含有杂质Fe2O3 . 利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示. 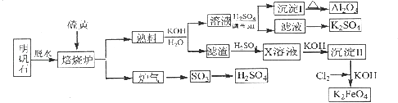
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) ![]() 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
(2)生成沉淀I的离子方程式为 , 沉淀II的化学式为 .
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: .
(5)从滤液中得到K2SO4晶体的方法是 .
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 4molL﹣1NaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 热的浓的NaOH溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率为v (PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正)>v (逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g)K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g)K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应 B. CO的平衡转化率为80%
C. 反应前H2S物质的量为7mol D. 通入CO后,正反应速率逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com