分析:(1)由表中数据可知,开始时的物质的量为1mol,故X、Y的起始浓度为
=0.5mol/L,Z的起始浓度为0,7min时反应到达平衡,平衡时X的物质的量为0.55mol,故X的平衡浓度为
=0.275mol/L,平衡时Z的物质的量为0.45mol,故Z的平衡浓度为
=0.225mol/L,据此作图;
(2)根据参加反应的物质的量之比等于计量数之比书写方程式;
(3)根据表中数据求出0-3min时间内产物Z的浓度变化,再求出反应速率;
(4)根据表中数据求出到达平衡时转化的X的物质的量,再求出转化率;
(5)根据温度、压强、催化剂对反应速率的影响分析.
解答:
解:(1)由表中数据可知,开始时的物质的量为1mol,故X、Y的起始浓度为
=0.5mol/L,Z的起始浓度为0,7min时反应到达平衡,平衡时X的物质的量为0.55mol,故X的平衡浓度为
=0.275mol/L,平衡时Z的物质的量为0.45mol,故Z的平衡浓度为
=0.225mol/L,以横坐标为时间,从坐标为X、Z的物质的量(n),
根据以上数据作图:
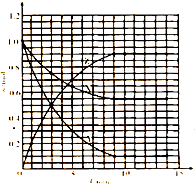
,
故答案为:

;
(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~9min物质的量变化值为1.00mol-0.55mol=0.45mol,
Y的物质的量减小,应为反应物,0~9min物质的量变化值为1.00mol-0.10mol=0.90mol,
Z的物质的量增多,应为是生成物,物质的量的变化值为0.90mol,
根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.45mol:0.90mol:0.90mol=1:2:2,则反应方程为:X+2Y?2Z;
故答案为:X+2Y?2Z;
(3)0-3min时间内产物Z的平均反应速率为:
=0.083 mol?L
-1?min
-1,故答案为:0.083 mol?L
-1?min
-1;
(4)到达平衡时剩余的X为0.55mol,则转化的X为1mol-0.55mol=0.45mol,所以X的转化率α=
×100%=45%,
故答案为:45%;
(5)A.降低温度,反应物中活化分子百分数减小,有效碰撞几率减小,所以反应速率减小;
B.将容器的体积改为1L,则容器的体积缩小,反应物的浓度增大,反应物中活化分子数目增大,有效碰撞几率增大,所以速率增大;
C.使用催化剂能降低反应所需活化能,反应物中活化分子百分数增大,有效碰撞几率增大,所以速率增大;
D.保持容器体积不变加入氦气,反应物的浓度不变,则反应速率不变;
故答案为:
| 改变的反应条件 |
反应速率改变的结果 |
| 降低反应体系的温度 |
减小 |
| 将容器的体积改为1L |
增大 |
| 使用催化剂 |
增大 |
| 保持容器体积不变,充入一定量氦气,增大压强 |
不变 |
.


 ,
, ;
;

 单质X2、Y和化合物Z的组成元素均为周期表中前20号元素,表格和图分别是X2、Y 和Z的有关信息以及他们之间的转化关系 (其他无关物质已略去).请回答下列问题:
单质X2、Y和化合物Z的组成元素均为周期表中前20号元素,表格和图分别是X2、Y 和Z的有关信息以及他们之间的转化关系 (其他无关物质已略去).请回答下列问题: