
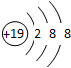
 ����X2��Y�ͻ�����Z�����Ԫ�ؾ�Ϊ���ڱ���ǰ20��Ԫ�أ������ͼ�ֱ���X2��Y ��Z���й���Ϣ�Լ�����֮���ת����ϵ ����������������ȥ������ش��������⣺
����X2��Y�ͻ�����Z�����Ԫ�ؾ�Ϊ���ڱ���ǰ20��Ԫ�أ������ͼ�ֱ���X2��Y ��Z���й���Ϣ�Լ�����֮���ת����ϵ ����������������ȥ������ش��������⣺| Ԫ��X | ���γ�-1��18���ӵĵ������� |
| Ԫ��Y | ��3���ڵڢ�A�� |
| ������Z | ������������3�����Ӳ� |
| ������0.1mol?L-1Z��ˮ��ҺpH=13 |
| 0.062 |
| 0.062��0.05 |
 ��
�� ��
��

 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ɫ��Һ�У�Na+��Cu2+��NO3-��Cl- |
| B����pH=8����Һ�У�Na+��K+��AlO2-��Cl- |
| C���ں�����Fe3+����Һ�У�NH4+��Na+��Cl-��SCN- |
| D����Al��Ӧ�����������Һ��Na+��K+��CO32-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ �� �� ʵ | �� �� | |
| A | ������1mol?L-1��������Ա�0.1mol?L-1����ǿ | ����ĵ������Ũ�ȵ���������� |
| B | SO2ͨ�����ᱵ��Һ���ְ�ɫ���� | BaSO3������ǿ�� |
| C | NaBr��Һ��ͨ��Cl2ʱ����Һ��Ȼ�ɫ | �ǽ����ԣ�Cl��Br |
| D | �������Ա������ᣨH2S��ˮ��Һ��ǿ | �ǽ����ԣ�Cl��S |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
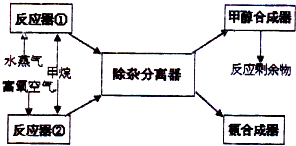 ij�������Լ���Ϊ��Ҫԭ������ȡ�ϳɼ״����ϳɰ���ԭ�ϣ�����Ҫ��ӦΪ��
ij�������Լ���Ϊ��Ҫԭ������ȡ�ϳɼ״����ϳɰ���ԭ�ϣ�����Ҫ��ӦΪ��| 2 |
| 3 |
| n(H2) |
| n(N2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 һ���¶��£���һ�������ı������ˮϡ�����У���Һ�ĵ��������仯��ͼ��ʾ���й�˵����ȷ���ǣ�������
һ���¶��£���һ�������ı������ˮϡ�����У���Һ�ĵ��������仯��ͼ��ʾ���й�˵����ȷ���ǣ�������| A��a��b��c������Һ��pH��a��b��c |
| B����ʹC���c(CH3COO-)������Һ��pHҲ���ɼ���������CH3COONa���� |
| C��a��b��c������Һ��1mol/L����������Һ�кͣ���������������Һ�����a��b��c |
| D����ʪ���pH��ֽ����c����Һ��pHֵ����ʵ��pHֵƫС |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

| �ı�ķ�Ӧ���� | ��Ӧ���ʸı�Ľ�� |
| ���ͷ�Ӧ��ϵ���¶� | |
| �������������Ϊ1L | |
| ʹ�ô��� | |
| ��������������䣬����һ��������������ѹǿ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com