
| 3.2g |
| 64g/mol |
| 0.05mol |
| 1L |
| 3.2g |
| 64g/mol |
| 0.05mol |
| 1L |
| 25 |
| 3 |
| 25 |
| 3 |
| 25 |
| 3 |
| 25 |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
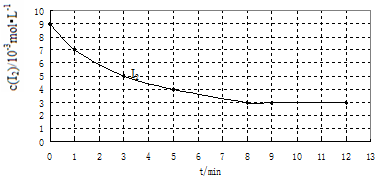
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� ��� |
ʵ��Ŀ�� | �¶�/�� | ���� ����/g |
��Ӧ���ʼŨ�� /10-3mol?L-1 | |
| H2 | I2 | ||||
| �� | Ϊ��������ʵ�������� | 457 | 0 | 7 | 9 |
| �� | 420 | 0 | 7 | 9 | |
| �� | ̽�������Ը÷�Ӧ���ʵ�Ӱ�� | 10 | 7 | 9 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ͭƬ�嵽��������Һ�У�Cu+2Ag+=Cu2++2Ag |
| B��ͭ��ϡ���ᷴӦ��Cu+2H+=Cu2++H2�� |
| C��̼��������Һ��ϡ�����ϣ�HCO3-+H+=CO2��+H2O |
| D������������Һ��ϡ�����ϣ�Ba2++H++OH-+SO42-=BaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/�� | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
| A���÷�Ӧ����ӦΪ���ȷ�Ӧ |
| B����ʼŨ�Ȳ��䣬KԽ��Ӧ���ת����Խ�� |
| C���¶Ȳ��䣬����X��������K���� |
| D����ƽ����������K���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C����ǿ����ʣ�������ˮ�е���������������ʾ��
A��B��C����ǿ����ʣ�������ˮ�е���������������ʾ��| ������ | Na+��K+��Cu2+ |
| ������ | SO42-��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����X2��Y�ͻ�����Z�����Ԫ�ؾ�Ϊ���ڱ���ǰ20��Ԫ�أ������ͼ�ֱ���X2��Y ��Z���й���Ϣ�Լ�����֮���ת����ϵ ����������������ȥ������ش��������⣺
����X2��Y�ͻ�����Z�����Ԫ�ؾ�Ϊ���ڱ���ǰ20��Ԫ�أ������ͼ�ֱ���X2��Y ��Z���й���Ϣ�Լ�����֮���ת����ϵ ����������������ȥ������ش��������⣺| Ԫ��X | ���γ�-1��18���ӵĵ������� |
| Ԫ��Y | ��3���ڵڢ�A�� |
| ������Z | ������������3�����Ӳ� |
| ������0.1mol?L-1Z��ˮ��ҺpH=13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ɫ��Һ�У�Na+��Cu2+��Cl-��NO3- |
| B��ǿ������Һ�У�Na+��K+��OH-��SiO32- |
| C����Fe3+����Һ�У�K+��Ca2+��NO3-��SCN- |
| D����������Һ�У�Fe2+��Na+��SO42-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com