
����Ŀ���-ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�D����������ܣ����зŵ����Ϊ2Li+Cu2O+H2O=2Cu+2Li++2OH������˵���������
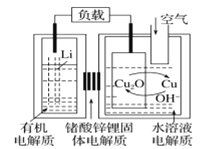
A.�ŵ�ʱ�������ĵ缫��ӦʽΪO2+2H2O+4e=4OH
B.�ŵ�ʱ��Li+���������������ƶ�
C.ͨ����ʱ��ͭ����ʴ���������Cu2O
D.������Ӧ�����У�������ΪO2
���𰸡�A
��������
A���ɵ�طŵ�����еķ���ʽΪ2Li+Cu2O+H2O=2Cu+2Li++2OH����صĸ�����ӦʽΪLi-e=Li+���ʵ�ص�������ӦʽΪCu2O+2e+H2O=2Cu+2OH��A˵������A�������⣻
B���ŵ�ʱ��Li�缫Ϊ������Cu�缫Ϊ�����������������������������������ʷŵ�ʱ��Li+��������������(ͭ�缫)�ƶ���B˵����ȷ����B���������⣻
C���ŵ�����еķ���ʽΪ2Li+Cu2O+H2O=2Cu+2Li++2OH����֪ͨ����ʱ��ͭ����ʴ���������Cu2O��C˵����ȷ����C���������⣻
D��ͨ����ʱ��ͭ����ʴ���������Cu2O���ŵ�ʱCu2Oת��ΪCu����������Ӧ�����У�Cu�൱�ڴ���������������ΪO2��D˵����ȷ����D���������⣻
��ѡ��A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ����ͼ��ʾ�������ܾ��е������ǣ� ��
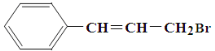
A. ��ʹ��ˮ��ɫ��������ʹ�������������Һ��ɫ
B. 1 mol ���л��������4 mol Br2�ӳ�
C. ��AgNO3��Һ��Ӧ��������ɫ����
D. ��NaOHˮ��Һ�м��ȿ��Է���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4L�ܱ������г���6molA�����5molB���壬һ�������·�����Ӧ��3A��g��+B��g��![]() 2C��g��+xD��g�����ﵽƽ��ʱ��������2molC�����ⶨ��D��Ũ��Ϊ0.5mol/L�������ж���ȷ���ǣ� ��
2C��g��+xD��g�����ﵽƽ��ʱ��������2molC�����ⶨ��D��Ũ��Ϊ0.5mol/L�������ж���ȷ���ǣ� ��
A.B��ת����Ϊ20%B.ƽ��ʱA��Ũ��Ϊ1.50mol/L
C.x��1D.�ﵽƽ��ʱ������ͬ�¶��������ڻ�������ѹǿ�Ƿ�Ӧǰ��85%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ij��Ӧ�ﵽƽ�⣬��ƽ�ⳣ��Ϊ![]() ������ʱ�������¶ȣ�����������ɫ�������˵����ȷ����
������ʱ�������¶ȣ�����������ɫ�������˵����ȷ����
A. �÷�Ӧ�Ļ�ѧ����ʽΪ��NO2��CO = CO2��NOB. �÷�Ӧ���ʱ�Ϊ��ֵ
C. �����¶ȣ�����Ӧ���ʼ�СD. ����ʱ������ѹǿ����ɫ�����ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����־��в�ͬ�����ķ��Ӱٷ����������Ķ�Ӧ��ϵͼ������һ���¶��·��������ֲ�����ͼ��ͼ��E��ʾ����ƽ��������Ec�ǻ���Ӿ��е��������������˵������ȷ���ǣ� ��
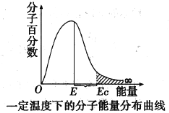
A.ͼ��Ec��E֮���ʾ���
B.�����¶ȣ�ͼ����Ӱ�������������
C.ʹ�ú��ʵĴ�����E���䣬Ec��С
D.��������Ec�ķ��Ӽ䷢������ײһ������Ч��ײ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ֧Ӳ�ʴ��Թܣ�ͨ���ű���ʳ��ˮ�ķ����Ⱥ��ռ����Թܼ���Ͱ��Թ�����(��ͼ)�����ж����Թ��ڷ����ķ�Ӧ�������˵����ȷ���ǣ� ��
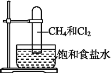
A.�˷�Ӧ����Ҳ�ɷ���
B.�����Cl2��Ӧ��IJ���ֻ��CH3Cl��HCl
C.CH4��Cl2��ȫ��Ӧ��Һ��������Һ������Թ�
D.ʢ�ű���ʳ��ˮ��ˮ�۵ײ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ�п�̵�غ���п����Ԫ�أ���Ҫ����ZnO��ZnMn2 O4��MnO��Mn2 O3��Mn3 O4��MnO2�����÷Ͼ�п�̵�ػ���п���Ʊ��������̡�����Ĺ���������ͼ��
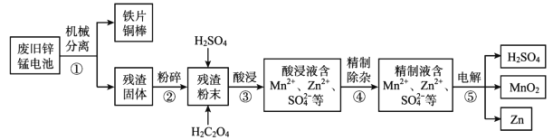
�ش��������⣺
(1)�����������������ҪĿ����______��
(2)������������������һϵ�з�Ӧ��
ZnO+ H2SO4= ZnSO4 + H2O��MnO+ H2SO4= MnSO4 + H2O��
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2��
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ��+2H2O��
�Ʋ� Mn2O3 �����ᷴӦ�����ӷ���ʽΪ______��
(3)��ͼ�ֱ��ʾ�������ʱѡ�ò�ͬŨ������Ͳ���� Zn��Mn �����ʵ�Ӱ�졣
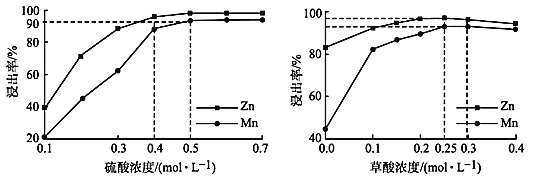
��Ϊ��֤ Zn��Mn �Ľ����ʾ����� 90%�����������Ƶ� c(H2SO4) = ____mol/L��H2C2O4 Ũ�ȶ� Mn �Ľ�����Ӱ��̶ȴ��� Zn����ԭ����_____��
�ڼ����������������Һ��Zn2+��Mn2+Ũ����ȡ��� c(H2C2O4)>0.25 mol/L ʱ��Zn��Mn �Ľ����ʷ����½�����Zn �Ľ������½�����Mn����ԭ�������_____(�����)��
a.���ŷ�Ӧ���� c(H+)����
b.Zn2+��Mn2+�� C2O42- ���ɳ���
c.�ܽ�ȣ�ZnC2O4��MnC2O4
(4)������ö��Ե缫��� ZnSO4 ��MnSO4 �Ļ����Һ�������� Zn��MnO2��H2SO4 �⣬ ���������� H2��O2 �������
������ MnO2 �ĵ缫��ӦʽΪ_____ ��
���� n (H2) ��n (O2)=2��1����μӷ�Ӧ�� n (Zn2+)��n (Mn2+) = ______��
�۸ù��������п�ѭ�����õ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ�������������ת����˵����ȷ���ǣ� ��
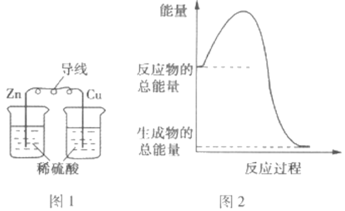
A.ͼ1��ʾ��װ���ܽ���ѧ��ת��Ϊ����
B.ͼ2��ʾ�ķ�ӦΪ���ȷ�Ӧ
C.�кͷ�Ӧ�У���Ӧ��������������������������
D.��ѧ��Ӧ�������仯�ĸ���ԭ���ǻ�ѧ���Ķ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ������ȡ�����װ�ã����з���װ����ͬ������ͼ���װ�������ף��ֱ���ͼ1��ͼ2��ʾ������ѡ������ȷ���� ( )
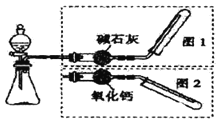
ѡ�� | ����װ���е�ҩƷ | ����ͼ���װ�� | |
A | �����������ƺ�Ũ���� | ͼ2 | |
B | ����ʯ��ϡ���� | ͼ1 | |
C | ͭ��ϡ���� | ͼ2 | |
D | �����ƺ�Ũ��ˮ | ͼ1 | |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com