
下列示意图与对应的反应情况符合的是
A.向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D.向NaAlO2溶液中逐滴加入盐酸至过量

科目:高中化学 来源: 题型:
I.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空,
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)并说明理由 。
(2)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI十HNO3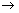 Se+I2+KNO3十H2O
Se+I2+KNO3十H2O
②I2+2Na2S2O3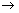 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.160 0 g,消耗了0.200 0 mol L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
II .高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,具有良好的应用前景。其生产工艺如下:
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12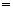 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在 (填“温度较高’’或“温度较低”)的情况下进行。
(2)写出Fe(NO3)3在强碱性条件下与KClO反应制K2FeO4的离子方程式 。
(3)在“反应液I”中加KOH固体的目的是 (填序号)。
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物 D.使副产物KClO3化为KClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.从1L 1 mol·L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol·L-1
B.物质的量是指物质所含微粒的数目
C.0.5 L 2 mol·L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.冰水混合物既是纯净物又是化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列实验事例,判断不正确的是
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
A.化合物KCrO2中Cr元素为+3价 B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性 D.实验③证明氧化性:Cr2O72- > I2
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体;同时产生红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A. 至少存在5种离子 B. Cl-一定存在,且c(Cl‑)≥0.4mol/L
C. SO42-、NH4+一定存在,Cl-可能不存在 D. CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下图中物质M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,阴离子元素最高正价与它的负价代数和为6。X具有漂白性,Y为碱性气体,W是对空气无污染的气体。试回答下列问题:
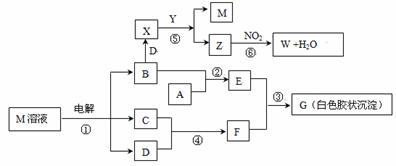
(1)写出电解M溶液①的化学方程式 。
(2)已知工业上制备Y气体,每生成1molY时放出的热量为akJ(该热量已合算成25℃,101KP),请写该反应的热化学方程式 。
(3)若A是一种常见金属,写出反应②的离子方程式 。
(4)若A是某元素的一种常见酸性氧化物,则A的化学式为 ;其用途为 。(写出一种即可)
(5)写出反应⑤的化学方程式 。
(6)标准状况下,反应⑥中生成11.2L W时转移的电子数 。(用NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是( )
A.H2SiO3 H2S CO2 B.MgSO4 CH3COOH CH3CH2OH
C.H2SO3 BaSO4 CH4 D.H2O NH3•H2O H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:( )
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:( )
A.用物质A表示的反应平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com