
【题目】中国科学家制得一种蓝色钨的氧化物(WOa),其中钨的质量分数为0.7985.
(1)a=(保留2位小数).
(2)WOa中存在五价和六价两种价态的钨.则蓝色钨的氧化物中这两种价态的钨原子数之比为 . 将铁锰的钨酸盐[(Fe,Mn)WO4]碱熔,发生如下反应(设空气中N2、O2的体积分数分别为0,.8和0.2):4FeWO4+4Na2CO3+O2 ![]() 4Na2WO4+2Fe2O3+4CO2 ①
4Na2WO4+2Fe2O3+4CO2 ①
2MnWO4+2Na2CO3+O2 ![]() 2Na2WO4+2MnO2+2CO2 ②
2Na2WO4+2MnO2+2CO2 ②
(3)根据反应①,若反应前空气为100L,反应后气体为160L(气体体积在同温同压下测定),则反应后所得气体中CO2的体积分数为 .
(4)某工厂投料550mol Na2CO3制备Na2WO4 , 每反应1mol O2时,气体就增加1.5mol,则生成物中Fe2O3与MnO2的物质的量之比为;若反应后气体增加300mol,制得Na2WO4mol.
(5)由Na2WO4制备W的第一步反应为:Na2WO4+2HCl→H2WO4↓+2NaCl.往1L密度为1,.190g/cm3的37%的浓盐酸加入6.030mol Na2WO4 , 恰好完全反应.将产生的沉淀过滤后,溶液中溶质只有NaCl,求该溶液中NaCl的质量分数(25℃时NaCl的溶解度为36.0g/100g水):
【答案】
(1)2.90
(2)1:4
(3)50%
(4)1:3;500
(5)解:水的质量为:1000×1.19×0.63=749.7g,生成NaCl为6.030×2×58.5=705.51g;749.7水可溶解NaCl为749.7×0.36=269.90 g,因为是饱和溶液,所以溶液中NaCl的质量分数为= ![]() =26.47%,答:该溶液中NaCl的质量分数26.47%.
=26.47%,答:该溶液中NaCl的质量分数26.47%.
【解析】解:(1)WOa中钨的质量分数为 ![]() =0.7985,解得a=2.90; 所以答案是:2.90;(2)把五价和六价两种价态的氧化物的化学式分别写成WO2.5和WO3 , 设蓝色氧化钨的组成为xWO2.5yWO3 ,
=0.7985,解得a=2.90; 所以答案是:2.90;(2)把五价和六价两种价态的氧化物的化学式分别写成WO2.5和WO3 , 设蓝色氧化钨的组成为xWO2.5yWO3 ,
因W和O的个数之比为1:2.90,则有 ![]() ,解得
,解得 ![]() ,所以蓝色氧化钨中五价和六价两种价态的钨的原子数之比为:1:4,所以答案是:1:4;(3)若反应前空气为100L,氧气只20L,由4FeWO4+4Na2CO3+O2
,所以蓝色氧化钨中五价和六价两种价态的钨的原子数之比为:1:4,所以答案是:1:4;(3)若反应前空气为100L,氧气只20L,由4FeWO4+4Na2CO3+O2 ![]() 4Na2WO4+2Fe2O3+4CO2 生成二氧化碳为80L,所以反应后所得气体中CO2的体积分数为
4Na2WO4+2Fe2O3+4CO2 生成二氧化碳为80L,所以反应后所得气体中CO2的体积分数为 ![]() ×100%=50%,所以答案是:50%;(4)4FeWO4+4 Na2CO3+O2═4 Na2WO4+2Fe2O3+4CO2 气体增加 ①
×100%=50%,所以答案是:50%;(4)4FeWO4+4 Na2CO3+O2═4 Na2WO4+2Fe2O3+4CO2 气体增加 ①
x 4x 4x 3x
2MnWO4+2Na2CO3+O2═2 Na2WO4+2MnO2+2CO2 气体增加 ②
y 2y 2y y
而每反应1mol O2时,气体就增加1.5mol,所以 ![]() ,解之得:
,解之得: ![]() ,生成物中Fe2O3与MnO2的物质的量之比为1:3,
,生成物中Fe2O3与MnO2的物质的量之比为1:3,
则Na2WO4为 ![]() =500 mol,所以答案是:1:3;500 mol;
=500 mol,所以答案是:1:3;500 mol;


科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 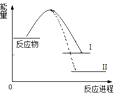
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 6.02×1023是阿伏加德罗常数的近似值
B. 阿伏加德常数个微粒的物质的量是1mol
C. 1mol12C原子的质量为12g
D. 硫酸的摩尔质量是98克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2molL﹣1的①(NH4)2SO4 , ②NaNO3 , ③NH4HSO4 , ④NH4NO3 , ⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
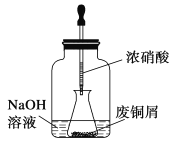
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式___________________________________________。
(2)上图装置中NaOH溶液的作用是_________________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_______________________。
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。
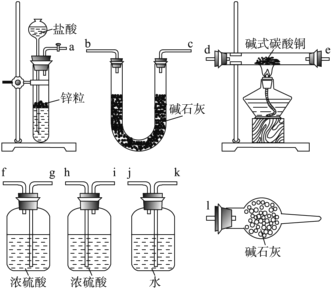
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式:__________________;
②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为______ g,化学式为____________。
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?__________(填“可行”或“不可行”)请说明理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】限用硫酸、盐酸、醋酸、钠盐、钾盐在溶液中反应,符合离子方程式2H++CO32-===H2O+CO2↑的化学方程式的个数有( )
A. 3B. 5C. 8D. 12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应,下列 叙述错误的是
A. 反应过程中能量关系可用下图表示

B. 若将该反应设计成原电池则锌为负极
C. ΔH 的值与反应方程式的化学计量数有关
D. 若将其设计为原电池,当有 32.5g 锌溶解时,正极放出气体一定为 11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com