
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H1-△H2=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
科目:高中化学 来源: 题型:
【题目】下列对于实验I~IV的说法正确的是( )

A.实验I:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验II:可比较氯、碳、硅三种元素的非金属性强弱
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L的CH3COONa溶液的pH=a,则下列说法正确的是
A.a<7
B.该溶液中水电离的c(OH-)=10-amol/L
C.CH3COO-水解的百分率为(10-a/0.1)×100%
D.c(CH3COOH)= (l0a-14-10-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
① SO2; ② CH3CH2CH=CH2; ③ ![]() ; ④ CH3CH3。
; ④ CH3CH3。
A.①②③④ B.①② C.①②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下CO2和H2可发生反应:CO2(g)+ H2(g)![]() CO (g)+H2O(g) △H
CO (g)+H2O(g) △H
已知:①CO和H2的燃烧热分别为-283.0 kJmol-1 和-285.8kJmol-1
②H2O(l)= H2O(g) △H=+44.0KJ·mol-1
(1)写出表示H2燃烧热的热化学方程式____________________。
CO2(g)+ H2(g)![]() CO(g)+ H2O(g) △H1=___________KJ·mol-1
CO(g)+ H2O(g) △H1=___________KJ·mol-1
(2)有利于提高CO2平衡转化率的措施有__________。
A.加压 B.升温
C.增大CO2浓度 D.投料比不变,增加反应物的浓度
(3)若CO2和H2初始投料比为1:1,反应达平衡时CO在平衡混和气中的体积分数为25%,则CO2的转化率为_________,该反应的平衡常数为_________,若CO2和H2初始投料比改为1:2,则CO2的平衡转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2![]() 2NH3。在一定温度下达到平衡,H2的转化率为80%。若在同一容器中充入NH3, 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是
2NH3。在一定温度下达到平衡,H2的转化率为80%。若在同一容器中充入NH3, 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是
A.15mol 20% B.20mol 20% C.20mol 80% D.40mol 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取溴,主要反应为2Br﹣+Cl2═Br2+2Cl﹣ , 下列说法中正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于取代反应
D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+nH2O→CaCl2·nH2O;CaCl2+8NH3→[Ca(NH3)8]Cl2,根据题意完成下列填空:
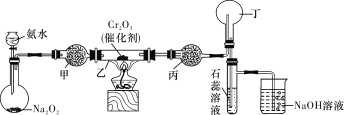
(1)分液漏斗中氨水的浓度为9.0 mol/L。现用质量分数为35%、密度为0.88 g/cm3的氨水配制9.0 mol/L的氨水100 mL,需要的定量仪器有 (选填编号)。
a.100 mL容量瓶 b.10 mL量筒 c.50 mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为 。
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有 。
(4)干燥管甲的作用是 ;丙中盛放的药品为 (选填下列编号),其目的是 。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有 (填写化学式)。烧杯中发生反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com