
����Ŀ�������Ϊ2 L�Ĺ̶��ܱ�������ͨ��3 mol X���壬��һ���¶��·������·�Ӧ��2X(g)![]() Y(g)��3Z(g)
Y(g)��3Z(g)
(1)��5 min��Ӧ�ﵽƽ�⣬��ʱ��������ڵ�ѹǿΪ��ʼʱ��1.2��������Y��ʾ������Ϊ____________ mol��L��1��min��1��
(2)��������Ӧ�ڼס��ҡ��������ĸ�ͬ�����ܱ������н��У���ͬһ��ʱ���ڲ�������ڵķ�Ӧ���ʷֱ�Ϊ�ף�v(X)��3.5 mol��L��1��min��1���ң�v(Y)��2 mol��L��1��min��1������v(Z)��4.5 mol��L��1��min��1������v(X)��0.075 mol��L��1��s��1��������������ͬ���¶Ȳ�ͬ�����¶��ɸߵ��͵�˳����(�����)______ ______��
(3)����ﵽ(1)��ƽ����ϵ�г��뺤������ƽ��__________(����������ҡ�����)�ƶ������Ӵﵽ(1)��ƽ����ϵ�����߲���Y���壬��ƽ��____________(����������ҡ�����)�ƶ���
(4)������ͬ��������ﵽ(1)������ƽ����ϵ���ٳ���0.5 mol X���壬��ƽ���X��ת������(1)��ƽ����X��ת������Ƚ�( )
A����ȷ�� B��ǰ��һ�����ں���
C��ǰ��һ�����ں��� D��ǰ��һ��С�ں���
(5)�������¶Ⱥ�ѹǿ���䣬��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊa mol��b mol��c mol���ﵽƽ��ʱ����(1)��ƽ���Ч����a��b��cӦ������Ĺ�ϵΪ___________________��
(6)�������¶Ⱥ�������䣬��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊa mol��b mol��c mol���ﵽƽ��ʱ����(1)��ƽ���Ч������ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���c��ȡֵ��Χ��_________��
���𰸡�(1)0.03 (2)�����ң��ף��� (3)�� ����
(4)D (5)c��3b��a��0 (6)0.9��c��4.5
��������
�����������1��2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
��ʼ����mol�� 3 0 0
ת������mol�� 2x x 3x
ƽ������mol��3��2x x 3x
ƽ��ʱ��������ڵ�ѹǿΪ��ʼʱ��1.2������![]() ��1.2�����x��0.3mol������ƽ��ʱY�����ʵ���Ũ�ȣ�0.3mol��2L��0.15mol/L�����Y�����ʵ���Ũ�ȱ仯��ʾ������Ϊ0.15mol/L��5min��0.03 mol/(Lmin)��
��1.2�����x��0.3mol������ƽ��ʱY�����ʵ���Ũ�ȣ�0.3mol��2L��0.15mol/L�����Y�����ʵ���Ũ�ȱ仯��ʾ������Ϊ0.15mol/L��5min��0.03 mol/(Lmin)��
��2����ͬһ��ʱ���ڲ�������ڵķ�Ӧ���ʷֱ�Ϊ����v(X)��3.5mol/(Lmin)����v(Y)��2mol/(Lmin)����v(Z)=4.5mol/(Lmin)����v(X)��0.075mol/(Ls)������ݷ�Ӧ����֮������Ӧ�Ļ�ѧ������֮�ȿ�֪���������X��ʾ��Ӧ���ʣ���ֱ���3.5mol/(Lmin)��4mol/(Lmin)��3.0mol/(Lmin)��4.5mol/(Lmin)���¶�Խ�߷�Ӧ����Խ�����Ը��ݷ�Ӧ���ʿ�֪���¶��ɸߵ��͵�˳����(�����) �����ң��ף�����
��3������ﵽ(1)��ƽ����ϵ�г�������������������ʵ�Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ�������ﵽ(1)��ƽ����ϵ�����߲��ֻ�����壬����������Ũ�Ƚ��ͣ���ƽ�������ƶ���
��4�����ڸ÷�Ӧ���������Ŀ��淴Ӧ���ҷ�Ӧ��ֻ��һ�֣�����ƽ����ٴ�ͨ��X���壬�൱������ѹǿ��ƽ�����淴Ӧ�����ƶ�������������ͬ��������ﵽ(1)������ƽ����ϵ���ٳ���0.5molX���壬��ƽ���X��ת������������ƽ���е�X��ת������Ƚ���һ��С��������ѡD��
��5���������¶Ⱥ�ѹǿ����,��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊamol��bmol��cmol���ﵽƽ��ʱ����(1)��ƽ���Ч,����ݷ���ʽ��������Y��Zǡ�ÿ�����ȫת��ΪX���ɣ�����a��b��cӦ������Ĺ�ϵΪc��3b��a��0��
��6���������¶Ⱥ�������䣬��ʼʱ����X��Y��Z���ʵ����ֱ�Ϊamol��bmol��cmol,�ﵽƽ��ʱ����(1)��ƽ���Ч������ݷ���ʽ��������Y��Zǡ�ÿ�����ȫת��ΪX��ʹX�����ʵ�������3mol���ɣ�����c�����ֵ��4.5mol������ƽ��ʱc�����ʵ�����0.9mol������Ҫ������ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ�������,��c�������0.9mol�����c��ȡֵ��Χ��0.9��c��4.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ���ã�4g�״�Һ̬�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�90kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ��_________________��
��2�� ��֪��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H��a kJ/mol���Ը��ݱ������м������ݹ���a����ֵ��_________________��
2NH3(g) ��H��a kJ/mol���Ը��ݱ������м������ݹ���a����ֵ��_________________��
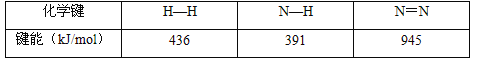
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣��֪��
C(s��ʯī)+O2(g)=CO2(g) ��H1=-393.5kJ��mol-1 ��
2H2(g)+O2(g)== 2H2O(I) ��H2=-571.6kJ��mol-1 ��
2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(I) ��H3 =-2599kJ��mol-1��
���ݸ�˹���ɣ�����298Kʱ��C(s��ʯī)��H2(g)����1mol C2H2(g)��Ӧ���ʱ䣺____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ԫ��ԭ�ӵ����������Ų�ʽ�����в��ܱ�ʾ��Ԫ��һ��Ϊ����Ԫ�ص��ǣ� ��
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�NaCl��NaClO��NaClO3�Ļ����Һ�����ⶨClO����ClO3����Ũ��֮��Ϊ1��3����Ӧʱ����ԭ����Ԫ���뱻��������Ԫ�ص�����֮��Ϊ �� ��
A��4��1 B��3��1 C��11��3 D�� 21��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
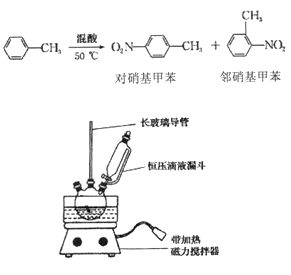
����Ŀ��ʵ�����Ʊ�һ�����ױ�����Ҫ���������ױ��Ͷ������ױ����ķ�Ӧԭ����ʵ��װ
�ܶ�/��g��cm-3) | �е㣯�� | ʽ�� | �ܽ��� | |
�ױ� | 0.866 | 110.6 | 92 | ������ˮ��������һ�����ױ� |
�������ױ� | 1.286 | 237.7 | 137 | ������ˮ��������Һ̬�� |
�������ױ� | 1.162 | 222 | 137 | ������ˮ��������Һ̬�� |
ʵ�鲽�裺
�� ���ƻ��ᣬ��װ��ͼ��Ӧװ�á�ȡ100 mL �ձ�����10 mL Ũ������30 mL Ũ������
�ƻ��ᣬ�����ѹ��Һ©���У���15 mL �ױ����ۺ�����13.0g������������ƿ�С�
�� �������µļױ�����μӻ��ᣬ�ߵα߽��裬��Ͼ��ȡ�
�� ��50һ60�� �·�����Ӧ��ֱ����Ӧ������
�� ��ȥ���������������ˮ��10% NaCO3��Һϴ�ӣ������������ˮϴ�ӵõ��ֲ�Ʒ��
��ش��������⣺
��l������40mL ����IJ�����________________
��2��װ���л�ȱ��__________�����������ƣ�������¶ȳ���60�棬������____�����������ƣ����ɡ�
��3������ֲ�Ʒ��ˮ�IJ���������__________
��4����Ʒ��10% NaCO3��Һϴ��֮����������ˮϴ�ӣ������Ʒ�Ƿ�ϴ�ɾ��IJ�����_______
��5��Ϊ�˵õ�������������������������Һ���м���_______��ȥˮ��Ȼ�����������յõ���Ʒ������Ϊ13.70g����һ�����ױ��IJ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ֻ���ز�����ʯīϩ��أ��ɳ��5���ӣ�ͨ��2Сʱ��һ��ʯīϩ����أ�2Li+S8=Li2S8������ԭ��ʾ��ͼ��ͼ����֪����缫��Ӧ�ĵ�λ�����ĵ缫���Ϸų����ܵĴ�С��Ϊ�õ�صı������������йظõ��˵������ȷ����
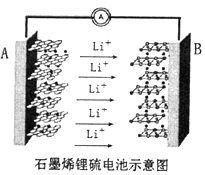
A. ����������н����б�������ߵĵ缫����
B. A�缫Ϊ�õ�Դ�ĸ���������������Ӧ
C. B�缫�ķ�Ӧ��2Li++S8+2e-=Li2S8
D. ���Ӵ�A�缫�������·����B�缫���پ������������A�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����
A. HCl��NaOH��Ӧ���к�����H����57.3kJ/mol����H2SO4��Ba(OH)2��Ӧ���к���Ҳ����H����57.3kJ/mol
B. CO(g)��ȼ������283.0kJ/mol����2CO2(g)=2CO(g)��O2(g) ��H��+566kJ/mol
C. ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D. 1mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����250Cijϡ��Һ�У���ˮ���������c(H+)=10-13mol/L�������й���Һ��������ȷ����( )
A������Һһ�������� B������Һһ���ʼ���
C������Һ��pH����Ϊ1 D������Һ��pHΪ7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������
A�����ۻ�������ֻ�����ۼ�
B�����ӻ������п��ܺ��й��ۼ�
C���ɱ���Ϊ������̼���壬�ۼ����ƻ�����������
D��̼��������ȷֽ�������������ƻ����Ӽ����ƻ��˹��ۼ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com