
【题目】(1)实验测得,4g甲醇液态在氧气中充分燃烧生成二氧化碳气体和液态水时释放出90kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
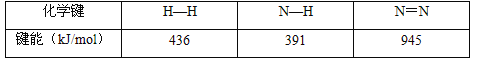
(2) 已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________________。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1 ①
2H2(g)+O2(g)== 2H2O(I) △H2=-571.6kJ·mol-1 ②
2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(I) △H3 =-2599kJ·mol-1③
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:____________。
【答案】(1)2CH3OH(I)+3O2=2CO2(g)+4H2O(I) △H=-1440 kJ/mol
(2)-93 (3)△H=+226.7 kJ/mol
【解析】
试题分析:(1)4gCH3OH在氧气中燃烧生成CO2和液态水,放出90kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1440kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1440KJ/mol;
(2)N2(g)+3H2(g)![]() 2NH3(g)△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1=a kJmol-1,因此a=-93。
2NH3(g)△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1=a kJmol-1,因此a=-93。
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJmol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJmol-1;
2C(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×1/2-③×1/2得到,
所以反应焓变△H=2×(-393.5kJmol-1)+(-571.6kJmol-1)×1/2-(-2599kJmol-1)×1/2=+226.7kJmol-1。


科目:高中化学 来源: 题型:
【题目】“环境保护”意识深入人心,下列关于酸雨的认识中错误的是
A..正常条件下,pH值小于5.6的降雨是“酸雨”
B.冰岛火山喷发含有大量SO2,在局部区域形成酸雨
C.全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害
D.汽车尾气含有氮氧化合物,过量排放形成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是
A.豆浆中加入CaSO4制豆腐
B.清晨在茂密的森林里看到缕缕阳光穿过林木枝叶
C.FeCl3溶液中加入NaOH溶液产生红褐色沉淀
D.江河入海口常有三角洲形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化性漂白剂。主要用于棉纺、亚麻、纸浆漂白、食品消毒、水处理、杀菌灭藻和鱼药制造。某化学兴趣小组对亚氯酸进行了研究,请回答下列问题。
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaC1。
(1)下列物质中与亚氯酸钠漂白原理相同的是_______。
A.H2O2 B.NaClO C.SO2 D.Al(OH)3胶体
(2)现利用下图所示装置(夹持装置省略)进行制取NaClO2晶体实验。
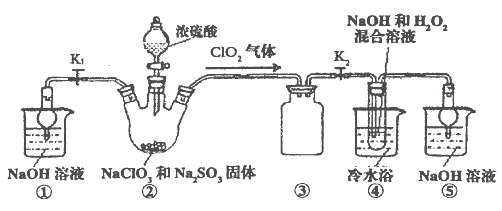
a.装置②中两种实验仪器的名称分别是_____________、___________。
b.装置②中产生ClO2的化学方程式为_________________________。
装置④中制备NaClO2的离子方程式为________________________。
c.装置③的作用是________________。
d.未反应完的ClO2在装置⑤中可被NaOH溶液吸收,生成的氧化产物与还原产物均为含氧酸盐,且二者的物质的量之比为1:1,请写出该反应的离子方程式______________________。
e.从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③___________;④低于60℃干燥,得到成品。
(3)用如下实验方案测定亚氯酸钠样品的纯度。
亚氯酸钠样品纯度测定实验用到的化学反应方程式为ClO2-+4I-+4H+=2H2O+2I2+Cl-、I2+2S2O32-=2I-+S4O62-
a.该测定实验用到的指示剂为_________________。
b.为测定亚氯酸钠样品纯度,需要用到下列实验数据中的___________(填写选项字母)
A.亚氯酸钠样品的质量(a g)
B.过量的碘化钾晶体的质量(b g)
C.稀硫酸的浓度(cmol/L)和体积(D mL)
D.指示剂的加入量(d mol)
E.标准液的浓度(e mol/L)和消耗体积(VmL)
用上述选定的数据表示出样品中NaC1O2 质量分数____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于普通玻璃的叙述中,正确的是( )
A. 它是人类最早使用的硅酸盐材料
B. 红色玻璃中含氧化亚铜
C. 它在加热熔化时有固定的熔点
D. 无色玻璃是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol﹒L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用。回答下列问题:
(1)已知:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示。
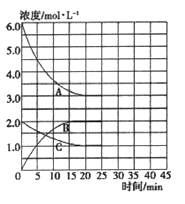
① 计算在该温度下反应2NH3(g) ![]() N2(g)+3H2(g)的平衡常数K=________。
N2(g)+3H2(g)的平衡常数K=________。
② 在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡。在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线。________
③ 已知:2N2(g)+6H2O(l) ![]() 4NH3(g)+3O2(g)△H=+1530.0KJ/mol则氢气的热值为_____。
4NH3(g)+3O2(g)△H=+1530.0KJ/mol则氢气的热值为_____。
(2)① N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:__________
② 用NaClO与NH3 制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-=OH-+NH2Cl
请写出第二步离子方程式:__________________
③ N2H4易溶于水,是与氨相类似的弱碱,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2 mol/L N2H4·H2O与0.lmol/L,盐酸等体积混合(忽略体积变化)。则此时溶液的PH等于________(忽略N2H4的二级电离)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为____________ mol·L-1·min-1。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(X)=3.5 mol·L-1·min-1;乙:v(Y)=2 mol·L-1·min-1;丙:v(Z)=4.5 mol·L-1·min-1;丁:v(X)=0.075 mol·L-1·s-1。若其他条件相同,温度不同,则温度由高到低的顺序是(填序号)______ ______。
(3)若向达到(1)的平衡体系中充入氦气,则平衡__________(填“向左”、“向右”或“不”)移动;若从达到(1)的平衡体系中移走部分Y气体,则平衡____________(填“向左”、“向右”或“不”)移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较( )
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为___________________。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com