
����Ŀ�������£�N2H4���ǵ������ֳ���������ڿ�ѧ�������������й㷺Ӧ�á��ش��������⣺
��1����֪��N2(g)+3H2(g) ![]() 2NH3(g) ��H��-92.4kJ��mol-1
2NH3(g) ��H��-92.4kJ��mol-1
�ں��¡����ݵ��ܱ������У��ϳɰ���Ӧ�ĸ�����Ũ�ȵı仯������ͼ��ʾ��
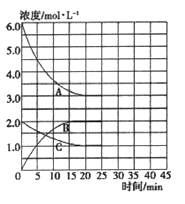
�� �����ڸ��¶��·�Ӧ2NH3(g) ![]() N2(g)+3H2(g)��ƽ�ⳣ��K=________��
N2(g)+3H2(g)��ƽ�ⳣ��K=________��
�� �ڵ�25minĩ�����������������䣬�����¶Ƚ��ͣ��ڵ�35minĩ�ٴδﵽƽ�⡣��ƽ���ƶ�������N2Ũ�ȱ仯��0.5mol/L������ͼ�л���25-40minNH3Ũ�ȱ仯���ߡ�________
�� ��֪��2N2(g)+6H2O(l) ![]() 4NH3(g)+3O2��g����H=+1530.0KJ/mol����������ֵΪ_____��
4NH3(g)+3O2��g����H=+1530.0KJ/mol����������ֵΪ_____��
��2���� N2H4��һ�ָ���ȼ�Ͼ��л�ԭ�ԣ�ͨ����NaClO�����NH3��Ӧ�Ƶã������Ϊʲô�ù���������Ӧ��ԭ��__________
�� ��NaClO��NH3 ��N2H4�ķ�Ӧ���൱���ӵģ���Ҫ��Ϊ������
��֪��һ����NH3+ClO-=OH-+NH2Cl
��д���ڶ������ӷ���ʽ��__________________
�� N2H4������ˮ�����백�����Ƶ������֪�䳣���µ��볣��K1=1.0��10-6�������£���0.2 mol/L N2H4��H2O��0.lmol/L������������ϣ���������仯�������ʱ��Һ��PH����________������N2H4�Ķ������룩��
���𰸡� 6.75 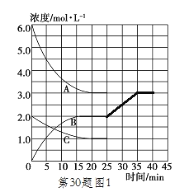 142.9 kJ ��g��1 ������NaClO���ܽ�N2H4����ΪN2���������ɣ� NH3+NH2Cl+OH����N2H4+Cl��+H2O 8
142.9 kJ ��g��1 ������NaClO���ܽ�N2H4����ΪN2���������ɣ� NH3+NH2Cl+OH����N2H4+Cl��+H2O 8
��������(l)�� ͼ��A��C�ı仯Ũ��֮��Ϊ3:1����AΪH2��CΪN2��BΪNH3��ƽ��ʱc(H2)Ϊ3.0mol/L��c(N2)Ϊ1.0mol/L��c(NH3)Ϊ2.0mol/L���ڸ��¶��·�Ӧ2NH3(g) ![]() N2(g)+3H2(g)��ƽ�ⳣ��K=
N2(g)+3H2(g)��ƽ�ⳣ��K=![]() =6.75��
=6.75��
���ڵ�25minĩ�����������������䣬��ӦN2(g)+3H2(g) ![]() 2NH3(g) ��H��-92.4kJ��mol-1��������ȣ������¶Ƚ��ͣ�ƽ�������ƶ�������Ũ������NH3Ũ�ȱ仯����Ϊ
2NH3(g) ��H��-92.4kJ��mol-1��������ȣ������¶Ƚ��ͣ�ƽ�������ƶ�������Ũ������NH3Ũ�ȱ仯����Ϊ ��
��
�� ��֪����2N2(g)+6H2O(l) ![]() 4NH3(g)+3O2(g)��H=+1530.0KJ/mol����N2(g)+3H2(g)
4NH3(g)+3O2(g)��H=+1530.0KJ/mol����N2(g)+3H2(g) ![]() 2NH3(g) ��H��-92.4kJ��mol-1��[����2-��]��6�ɵ�H2(g) +
2NH3(g) ��H��-92.4kJ��mol-1��[����2-��]��6�ɵ�H2(g) +![]() O2(g)=H2O(l) ����H��[(-92.4kJ��mol-1)��2-(+1530.0KJ/mol)]��6=-285.8kJ ��mol��1����2g������ȫȼ�շų�������Ϊ285.8kJ ������������ֵΪ142.9 kJ ��g��1��
O2(g)=H2O(l) ����H��[(-92.4kJ��mol-1)��2-(+1530.0KJ/mol)]��6=-285.8kJ ��mol��1����2g������ȫȼ�շų�������Ϊ285.8kJ ������������ֵΪ142.9 kJ ��g��1��
(2)�� NaClO��ǿ�����ԣ����NaClO�����ܽ�N2H4����ΪN2����ͨ����NaClO�����NH3��Ӧ��N2H4����N2H4��NaClO������
��NaClO��NH3��N2H4���ܷ�Ӧ��NaClO+2NH3=N2H4+NaCl+H2O�������ӷ�Ӧ����ʽΪClO-+2NH3=N2H4+Cl-+H2O����ڶ������ӷ���ʽ�����ܷ�Ӧ���ӷ��̼�ȥ��һ����NH3+ClO-=OH-+NH2Cl ��NH3+NH2Cl+OH����N2H4+Cl��+H2O ��
������0.2mo1L-1N2H4H2O��Һ��0.1molL-1HCl��Һ�������ϣ��õ����ʵ�Ũ�����N2H5C1��N2H4H2O��N2H5++H2O![]() N2H4H2O+H+��c(H+)=
N2H4H2O+H+��c(H+)=![]() =
=![]() mol/L=1��10-8mol/L��pH=8��
mol/L=1��10-8mol/L��pH=8��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�账����������ŷ������з�ˮ�����ķ�����������(����)
A. ���кͷ���ȥ��ˮ�е���
B. �û�������ȥ��ˮ�е��ؽ�������
C. ��������ȥ��ˮ�е�������
D. �ó�����ȥ��ˮ�е���ζ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ���ã�4g�״�Һ̬�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�90kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ��_________________��
��2�� ��֪��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H��a kJ/mol���Ը��ݱ������м������ݹ���a����ֵ��_________________��
2NH3(g) ��H��a kJ/mol���Ը��ݱ������м������ݹ���a����ֵ��_________________��
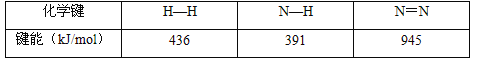
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣��֪��
C(s��ʯī)+O2(g)=CO2(g) ��H1=-393.5kJ��mol-1 ��
2H2(g)+O2(g)== 2H2O(I) ��H2=-571.6kJ��mol-1 ��
2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(I) ��H3 =-2599kJ��mol-1��
���ݸ�˹���ɣ�����298Kʱ��C(s��ʯī)��H2(g)����1mol C2H2(g)��Ӧ���ʱ䣺____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CCTV���Ƽ���������Ŀ�������ҹ���ѧ���״���CO2Ϊԭ���Ʊ��ɽ������������۶�����̼���������˵����������(����)
A. �۶�����̼�������ڸ߷��ӻ�����
B. �۶�����̼��������������
C. �۶�����̼�����к���CO2����
D. ʹ�þ۶�����̼��������ɻ�����Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ˮ���˵������ȷ����
A. �κ��ξ��ܷ���ˮ�� B. ��Һ��pH �������
C. ʹˮ�ĵ���̶����� D. ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ����ļ����������ɵĻ�����壬������ʱ��Ĺ��գ����õ��IJ����м��֣� ��
A.1 ��
B.2 ��
C.4 ��
D.5 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ԫ��ԭ�ӵ����������Ų�ʽ�����в��ܱ�ʾ��Ԫ��һ��Ϊ����Ԫ�ص��ǣ� ��
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�NaCl��NaClO��NaClO3�Ļ����Һ�����ⶨClO����ClO3����Ũ��֮��Ϊ1��3����Ӧʱ����ԭ����Ԫ���뱻��������Ԫ�ص�����֮��Ϊ �� ��
A��4��1 B��3��1 C��11��3 D�� 21��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����250Cijϡ��Һ�У���ˮ���������c(H+)=10-13mol/L�������й���Һ��������ȷ����( )
A������Һһ�������� B������Һһ���ʼ���
C������Һ��pH����Ϊ1 D������Һ��pHΪ7
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com