
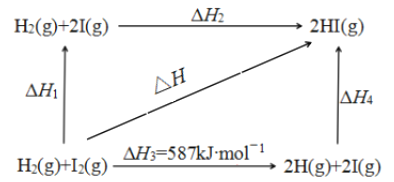
����Ŀ���⼰�仯������������ռ����Ҫ��λ����֪��ӦH2(g) + I2(g)![]() 2HI(g) ��H=��11 kJ��mol��1��716Kʱ����һ�ܱ������а����ʵ�����1:1����H2(g)��I2(g)��������������е⻯������ʵ��������뷴Ӧʱ��Ĺ�ϵ����ͼ��
2HI(g) ��H=��11 kJ��mol��1��716Kʱ����һ�ܱ������а����ʵ�����1:1����H2(g)��I2(g)��������������е⻯������ʵ��������뷴Ӧʱ��Ĺ�ϵ����ͼ��

(1)����Ӧ��ʼʱ�����������ѹΪp kPa����Ӧ��ǰ20 min�ڵ�ƽ������![]() (HI)=_____kPa��min��1(�ú�p��ʽ�ӱ�ʾ)��
(HI)=_____kPa��min��1(�ú�p��ʽ�ӱ�ʾ)��
(2)��Ӧ��ƽ��ʱ��H2��ת������(H2)=____________��
(3)������Ӧ�У�����Ӧ����Ϊv��= k����c(H2)��c(I2)���淴Ӧ����Ϊv��=k����c2(HI)������k����k��Ϊ���ʳ����������¶ȣ�![]() ________(��������������С������������)��
________(��������������������������)��
(4)�����¶ȣ�ƽ����������ƶ���ԭ����__________��
(5)1 mol H2(g)�����л�ѧ������ʱ��Ҫ����436 kJ����������ͼ�е���H2=________kJmol��1
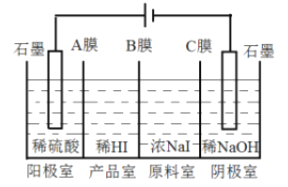
(6)��������������ʽ�����������Ʊ������װ�ü���ʼ�ĵ������Һ����ͼ��ʾ��
�������缫��ӦʽΪ______________��
����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ����AĤΪ��Ĥ����BĤΪ______Ĥ��CĤΪ______Ĥ��
���𰸡�0.03 p 78.4% ��С ����ʹ��������Ϊ��̬����̬��Ũ�Ƚ���ƽ�������ƶ� ��162 2H2O��4e��===4H����O2�� �� ��
��������
��1���г�����ʽ���������ʹ�ʽ���㣻
��2������ת���ʹ�ʽ���㣻
��3������ƽ��ʱ�������淴Ӧ������ȣ�![]() ����Ӧ��ƽ�ⳣ����H2(g) + I2(g)
����Ӧ��ƽ�ⳣ����H2(g) + I2(g)![]() 2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���
2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���![]() ��С��
����
��4�������¶ȣ�ƽ����������ƶ���ԭ���ǣ�����ʹ��������Ϊ��̬��
��5����ͼ���ݸ�˹���ɼ��㣻
��6����ˮ����������������Ӧ����������
����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ����AĤΪ��Ĥ����������ͨ������BĤΪ��Ĥ������������ͨ����CĤΪ��Ĥ������������ͨ����
��1��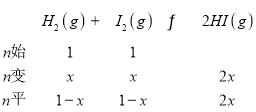
��ͼ![]() ��x=0.6��
��x=0.6��
![]() (HI)=
(HI)=![]() ==0.03pkPa��min��1
==0.03pkPa��min��1
��2����Ӧ��ƽ��ʱ��HI���������Ϊ0.784��![]() ��x=0.784��H2��ת������(H2)=
��x=0.784��H2��ת������(H2)=![]() =78.4%��
=78.4%��
��3������ƽ��ʱ�������淴Ӧ������ȣ�����Ӧ����Ϊv��= k����c(H2)��c(I2)���淴Ӧ����Ϊv��=k����c2(HI)��v��= k����c(H2)��c(I2)=k����c2(HI)=v����![]() =
=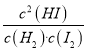 =K��H2(g) + I2(g)
=K��H2(g) + I2(g)![]() 2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���
2HI(g) ��H=��11 kJ��mol��1�������¶ȣ�ƽ�������ƶ���![]() ��С��
����
��4�������¶ȣ�ƽ����������ƶ���ԭ���ǣ�����ʹ��������Ϊ��̬����̬��Ũ�Ƚ���ƽ�������ƶ���
��5��1 mol H2(g)�����л�ѧ������ʱ��Ҫ����436 kJ����������ͼ��H3=587kJmol��1��1 mol I2(g)�����л�ѧ������ʱ��Ҫ����587KJ-436 kJ=151KJ������������H2=151kJmol��1������H1+��H2=��H����H2=��H-��H1=��-11-151��kJmol��1=-162kJmol��1��
��6����ˮ����������������Ӧ���������������缫��ӦʽΪ2H2O��4e��===4H����O2����
����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ����AĤΪ��Ĥ����������ͨ������BĤΪ��Ĥ������������ͨ����CĤΪ��Ĥ������������ͨ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������������
A.�к͵ζ�ʱʢ����Һ����ƿ��������ˮ�Եζ������Ӱ��
B.��NO2������ˮ����ɫ��dz��2NO2(g)(����ɫ)![]() N2O4(g)(��ɫ)��H��0
N2O4(g)(��ɫ)��H��0
C.������к͵ζ�ʵ���У�װ��Һ�ĵζ���������ϴ����ʵ����ƫ��
D.�����ȼ����Ϊ��H��-890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽΪ��CH4(g)��2O2(g)==CO2(g)��2H2O(g)��H��-890.3kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ���ʽ����ʾ��������ԭ��Ӧ���һ��ԭ��أ�Fe + H2SO4 = H2��+ FeSO4
(1)װ�ò����ձ������ţ�������ԭ��ص�װ��ͼ______________
(2)ָ��ԭ��ص��������Ϻ������ϲ�������ӵ�����:��������_________����������________ �����ӵ�����_________
(3)д�������缫�ϵĵ缫��Ӧ��ָ����������Ӧ ___________ ������___________������Ӧ___________������_________________
(4)ת�Ƶĵ�����Ϊ2NAʱ�����ɵ�H2�ڱ�״���µ����Ϊ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֳּ���̽�����������Ʊ�ʵ��絼��(�絼��Խ���ʾ��������Խǿ)�ı仯��Ũ�Ⱦ�Ϊ0.5 mol��L��1 ���������ƺͰ�ˮ�ֱ�ζ�0.01 mol��L��1��������Һ���絼�ʱ仯������ͼ��ʾ������˵���������
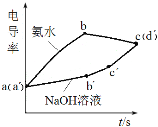
A.a(a)����ҺpH��7
B.bc�ε絼���½�����Ϊ������Al(OH)3����
C.ab�κ�bc��ʹ�ü�������ԼΪ3:1
D.b����Һ��c(H+)��2c(SO42��)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ��NaCN��Һ��CN����HCNŨ����ռ����(��)��pH�仯�Ĺ�ϵ����ͼ����ʾ����10 mL 0.01 mol��L��1 NaCN��Һ����μ���0.01 mol��L��1�����ᣬ��pH�仯��������ͼ����ʾ��
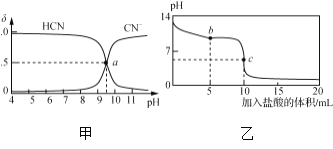
������Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����(����)
A. ͼ����pH��7����Һ��c(Cl��)��c(HCN)
B. ͼ����a�����Һ��c(CN��)<c(Cl��)
C. ͼ����b�����Һ��c(CN��)>c(Cl��)>c(HCN)>c(OH��)>c(H��)
D. ͼ����c�����Һ��c(Na��)��c(H��)��c(HCN)��c(OH��)��2c(CN��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ɫ��������ˮ����������ҵ��������������Ϊԭ�ϣ�ͨ������(FeOOH)�Ʊ�������أ��ɽ��������ɱ��Ҳ�Ʒ�����š��������̣�
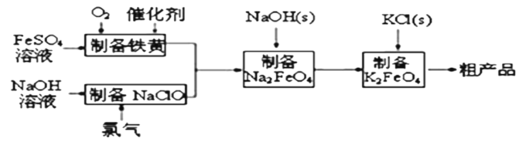
�ش��������⣺
(1)��֪�������£�Ksp[Fe(OH)3]=4.0��10��38��������صľ�ˮ�������ˮ��pH�йأ�����ҺpH=2ʱ����ˮ��c(Fe3+)=_______________molL��1
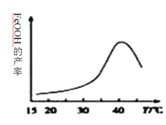
(2)�Ʊ����Ƶ����ӷ���ʽΪ_______________��ʵ���÷�Ӧ��Һ��pH���¶ȶ����Ʋ��ʵ�Ӱ����ͼ��ʾ����Ӧ�¶���ѡ��_________��
(3)�ٸ���������ˮ��Һ�������ֺ������塣25��ʱ�����ǵ����ʵ���������pH�ı仯��ͼ��ʾ��
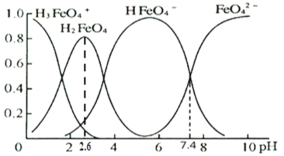
pH=2.6ʱ����Һ����Ҫ��������Ũ�ȵĴ�С��ϵΪ________��
����֪H3FeO4+���볣���ֱ�Ϊ��K1=2.51��10��2��K2=4.16��10��4��K3=5.01��10��8����pH=4ʱ����Һ��![]() =________��
=________��
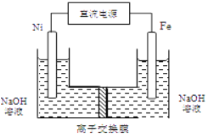
(4)��ҵ�ϻ�����ͨ�����ŨNaOH��Һ�Ʊ�Na2FeO4���乤��ԭ����ͼ��ʾ�������ĵ缫��ӦʽΪ__________�����п�ѭ��ʹ�õ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������м��������ټ���(����400��)�������ʵ���Һ�����Եõ������ʹ�������� ��
A���Ȼ��� B��̼������ C���������� D������þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶Ȳ��䡢���ݵ������н��з�Ӧ2HI![]() H2+I2(����ӦΪ���ȷ�Ӧ)����Ӧ���Ũ����0.1 mol/L����0.06 mol/L����Ҫ20 s����ô��0.06 mol/L����0.036 mol/L����ʱ��Ϊ( )
H2+I2(����ӦΪ���ȷ�Ӧ)����Ӧ���Ũ����0.1 mol/L����0.06 mol/L����Ҫ20 s����ô��0.06 mol/L����0.036 mol/L����ʱ��Ϊ( )
A.����10 sB.����12 sC.����12 sD.��12 s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������������Ժ� CO2 ������Ӧ��Fe(s)��CO2(g)FeO(s)��CO(g)��һ���¶��£���ij�ܱ������м����������۲�����һ������ CO2 ���壬��Ӧ������ CO2 ����� CO �����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��

(1)t1 ʱ�������淴Ӧ���ʵĴ�С��ϵΪ v ��_____v ��(����������������������)��
(2)4 min �ڣ�CO ��ƽ����Ӧ���� v(CO)��_____��
(3)���������ĸı��ܼ����䷴Ӧ���ʵ���_____(����ţ���ͬ)��
�ٽ����¶�
�ڼ������۵�����
�۱���ѹǿ���䣬���� He ʹ�������������
�ܱ����ݻ����䣬���� He ʹ��ϵѹǿ����
(4)����������˵��������Ӧ�Ѵ�ƽ��״̬����_____��
��v(CO2)��v(CO)
�ڵ�λʱ�������� n mol CO2 ��ͬʱ���� n mol CO
������������ѹǿ����ʱ��仯���仯
�������������ƽ����Է�����������ʱ��仯���仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com