
����Ŀ��(1)��������ʱ������![]() Ϊȼ�ϣ��ö�������Ϊ�����������������ʷ�Ӧ���ɵ�����ˮ��������֪��
Ϊȼ�ϣ��ö�������Ϊ�����������������ʷ�Ӧ���ɵ�����ˮ��������֪��
��![]() ��
��![]()
��![]() ��
��![]() ��
��
д���ºͶ���������Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽ��______��
(2)������ȼ����Ϊ![]() ��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ______��
��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ______��
(3)���������������ʷֱ���ȫȼ�գ��ų������϶���Ƿ�Ӧ����________![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.������ ![]() ������
������
(4)��֪��ͨ�������£�ǿ�ᡢǿ��ϡ��Һ�к�����![]() �ų�������Ϊ�к��ȡ�ϡ��Һ��
�ų�������Ϊ�к��ȡ�ϡ��Һ��![]() ������NaOHǡ�÷�Ӧʱ�ų�QkJ�����������к���Ϊ________
������NaOHǡ�÷�Ӧʱ�ų�QkJ�����������к���Ϊ________![]() ��
��
(5)��֪![]() ��
��![]() ��Ӧ���ȣ��ҶϿ�
��Ӧ���ȣ��ҶϿ�![]() ����
����![]() ����
����![]() �����յ������ֱ�Ϊ
�����յ������ֱ�Ϊ![]() ��
��![]() ��
��![]() ���ɴ���֪���й�ϵ��ȷ����________
���ɴ���֪���й�ϵ��ȷ����________![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.![]()
![]()
![]()
![]()
���𰸡�![]()
![]()
![]()
![]()
![]()
��������
������Ҫ���黯ѧ�������ܵ����֪ʶ���ѶȲ���ע����ȷ���ø�˹���ɡ�
(1)���ݸ�˹����![]() �ɵõ���Ӧ���ʱ䣻
�ɵõ���Ӧ���ʱ䣻
(2)ȼ���ȵĻ�ѧ����ʽ��ע�������ȶ��������
(3)��������ͬһ���ʣ���̬�ȹ�̬���е������ߣ�
(4)�����к��ȵĶ����жϣ�
(5)���öϼ���Ҫ���յ�������ȥ�ɼ��ͷŵ��������㷴Ӧ���ʱ䡣
![]() ��֪��
��֪��![]() ��
��![]()
![]() ��
��![]() �����ݸ�˹����
�����ݸ�˹����![]() �ɵã�
�ɵã�![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ����ȼ���ȵĶ��壬ע��ˮΪҺ̬��������ȼ���ȵ��ȷ���ʽΪ��
����ȼ���ȵĶ��壬ע��ˮΪҺ̬��������ȼ���ȵ��ȷ���ʽΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��������ͬһ���ʣ���̬�ȹ�̬���е������ߣ������������Ϊ��̬�������������ͬ����������֪��������ȼ��ʱ���������ͷŵ������࣬
��������ͬһ���ʣ���̬�ȹ�̬���е������ߣ������������Ϊ��̬�������������ͬ����������֪��������ȼ��ʱ���������ͷŵ������࣬
�ʴ�Ϊ��![]()
![]() ϡ��Һ��
ϡ��Һ��![]() ������NaOHǡ�÷�Ӧʱ����
������NaOHǡ�÷�Ӧʱ����![]() ���ų�QkJ������������
���ų�QkJ������������![]() �ų�
�ų�![]() ������
������
�ʴ�Ϊ��![]() ��
��
![]() �к�
�к�![]() �����Ͽ�
�����Ͽ�![]() ��
��![]() ��
��![]() �������յ������ֱ�Ϊ
�������յ������ֱ�Ϊ![]() ��
��![]() ��
��![]() ��������
��������![]() ���ų�
���ų�![]() ���������ڷ�Ӧ
���������ڷ�Ӧ![]() �Ͽ�
�Ͽ�![]() ����
����![]() �������յ�����
�������յ�����![]() �������¼��ͷŵ�����Ϊ
�������¼��ͷŵ�����Ϊ![]() kJ���÷�Ӧ���ȣ�
kJ���÷�Ӧ���ȣ�![]() ����
����![]() ��
��
�ʴ�Ϊ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У���ӦaA��g��![]() bB��g����ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����
bB��g����ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����
A.ƽ�����淴Ӧ�����ƶ���
B.����A��ת���ʼ�С��
C.����B����������������
D.a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��ȷ����
A. �����ȼ������H����890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)��2O2(g)=CO2(g)��2H2O(g) ��H����890.3kJ��mol��1
B. 500�桢30MPa�£���0.5molN2(g)��1.5mol H2(g)�����ܱ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪN2(g)��3H2(g)![]() 2NH3(g) ��H����38.6kJ��mol��1
2NH3(g) ��H����38.6kJ��mol��1
C. HCl��NaOH��Ӧ���к�����H��-57.3kJ��mol��1����H2SO4��Ca(OH)2��Ӧ���к�����H��2��(-57.3)kJ��mol��1
D. ��֪2C(s)��2O2(g)=2CO2(g) ��H��a��2C(s)��O2(g)=2CO(g) ��H��b����a<b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������δ�������������Դ��
(1)ʵ���ã�1g����ȼ������Һ̬ˮʱ�ų�![]() ������������ȼ�յ��Ȼ�ѧ����ʽΪ________
������������ȼ�յ��Ȼ�ѧ����ʽΪ________![]() �����
�����![]() ��
��
A.![]()
![]()
B.![]()
![]()
C.![]()
![]()
D.![]()
![]()
(2)ij��ѧ�Ҹ�����ԭ�Ӿ�������˼�룬����������Ʊ�![]() �ķ�Ӧ���裺
�ķ�Ӧ���裺![]()
![]()
![]()
![]()
![]()
���������ԭ�Ӿ�������˼�������������![]() �Ļ�ѧ����ʽ��__________������������ɫ��ѧ����˼�������÷�����
�Ļ�ѧ����ʽ��__________������������ɫ��ѧ����˼�������÷�����![]() ����Ҫȱ�㣺_______��
����Ҫȱ�㣺_______��
(3)���ú��ֽܷ�ˮ����������Ŀǰ�����о��Ŀ��⡣��ͼ�����е�һ�����̣��������˹����ĵ⡣

������з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ![]() ��________________________________��
��________________________________��
��Ӧ![]() ��________________________________��
��________________________________��
�˷���ȡ����������ŵ���________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ˮ��Һ�н������µ���ƽ��: CH3COOH![]() H++ CH3COO-����ֻ�ı�һ��������һ������ʹc(CH3COOH)/c(H+)��С����
H++ CH3COO-����ֻ�ı�һ��������һ������ʹc(CH3COOH)/c(H+)��С����
A. ͨ�Ȼ������� B. ������������ع���
C. ���������������ƹ��� D. ͨ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ,H3Aˮ��Һ(һ������Һ)�к�A�ĸ������ӵķֲ�����[ƽ��ʱij�����ӵ�Ũ��ռ��������Ũ��֮�͵ķ���(��)]��pH�Ĺ�ϵ��ͼ��ʾ������������ȷ����(����)
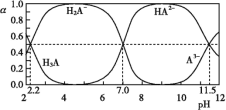
A.����ͼ,�ɵ�Ka1(H3A)��10-7
B.�������ʵ�����NaH2A��Na2HA���������ˮ,���õ���Һ�Ц�(H2A-)=��(HA2-)
C.�Է�̪Ϊָʾ��(��ɫ��ΧpH 8.2��10.0)����NaOH��Һ��μ���H3A��Һ��,����Һ����ɫ��Ϊdz��ɫʱֹͣ�μ�,������NaH2A
D.��������A�ĸ������ӵ���ϵ��,����ҺpHΪ11.5ʱ����c(H2A-)+5c(A3-)+c(OH-)=c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͬ���ʵ���Ũ���µĸ���Һ��NaX��NaY��NaZ����pHֵ����Ϊ8��9��10����HX��HY��HZ��������ǿ������˳��Ϊ:________________________________
(2)��AlCl3����ˮ���������������ɣ����գ�������ð�ɫ�������Ҫ�ɷ���__________________
(3)��һ���¶��£���a���ᣬb���ᣬc���������ᡣ(�����)
�ٵ������ʵ���Ũ����ͬʱ��c(H+)�ɴ�С��˳���� _______________��
��ͬ�����ͬ���ʵ���Ũ�ȵ������ᣬ�к�NaOH�������ɴ�С��˳���� ____________��
�۵�����c(H+)��ͬʱ�����ʵ���Ũ���ɴ�С��˳��Ϊ ____________________��
(4)���ܵ���ʵ�ˮ��Һ�д������ܽ�ƽ�⡣��֪���ڳ����£� K sp [Cu(OH)2]=2.0��10-20д��Cu(OH)2�ܶȻ���������ʽ___________________________________����Һ�и�����Ũ��ϵ���η��ij˻������ܶȻ�ʱ���������������֮�����ܽ⡣ijCuSO4��Һ��c(Cu2+)=0��02mol/L����Ҫ����Cu(OH)2������Ӧ������Һ��pH��ʹ֮���� _______________���ܴﵽĿ�ġ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ����
A.��16g��ԭ�ӵĶ������辧���к��е�����ĿΪ1NA
B.1 mol N2��4 mol H2��Ӧ���ɵ�NH3������Ϊ2NA
C.50��ʱ��1.0 L pH��1��H2SO4 ��Һ�к��е�H+��ĿΪ0.1NA
D.12 gʯīϩ(����ʯī)�к�����Ԫ������ĿΪ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ���������ݻ���Ϊ1 L�ĺ����ܱ������н�������Ӧ��2NO2(g)![]() 2NO(g)+O2 (g) (����Ӧ����)��ʵ����: v��= v(NO2)����=k��c2(NO2 )��v��= v(NO)����=2v(O2)����= k��c2 (NO)��c(O2 )��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
2NO(g)+O2 (g) (����Ӧ����)��ʵ����: v��= v(NO2)����=k��c2(NO2 )��v��= v(NO)����=2v(O2)����= k��c2 (NO)��c(O2 )��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
������� | ���ʵ���ʼŨ��(mol��L-1) | ���ʵ�ƽ��Ũ��(mol��L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
�� | 0 | 0.5 | 0.35 | |
A. ��ƽ��ʱ������I���������е���ѹǿ֮��Ϊ 4��5
B. ��ƽ��ʱ�������Т��� c(O2)/ c(NO2) ������I�еĴ�
C. ��ƽ��ʱ����������NO���������С��50%
D. ���¶ȸı�Ϊ T2ʱ���� k��=k������ T2<T1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com