
【题目】(1)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为:4NH3+5O2![]() 4NO+6H2O,该反应的氧化剂为______,还原剂为______。用单线桥法表示该氧化还原反应电子转移的方向和数目: _____________。若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为______ (写出含字母的表达式)。
4NO+6H2O,该反应的氧化剂为______,还原剂为______。用单线桥法表示该氧化还原反应电子转移的方向和数目: _____________。若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为______ (写出含字母的表达式)。
(2)写出下列反应的离子方程式。
①铝片与硝酸汞溶液反应_______________。
②向MgCl2溶液中滴加氨水(NH3·H2O)生成Mg(OH)2沉淀_______________。
(3)向MgCl2溶液中滴加氨水,过滤得到Mg(OH)2沉淀,用蒸馏水对沉淀进行洗涤,洗涤方法是向过滤器中注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流出,重复操作2~3次(以除去吸附溶液中的其它离子)。检验该沉淀已经洗净的操作为_______________。
【答案】 O2 NH3 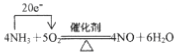 22.4n/5V 3Hg2++2Al=2Al3++3Hg Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ 取最后一次洗涤液放入试管中,向该溶液中滴加AgNO3溶液,若无沉淀产生则证明沉
22.4n/5V 3Hg2++2Al=2Al3++3Hg Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ 取最后一次洗涤液放入试管中,向该溶液中滴加AgNO3溶液,若无沉淀产生则证明沉
淀已洗净
【解析】试题分析:本题考查氧化还原反应的分析,离子方程式的书写,基本实验操作。
(1)反应中O元素的化合价由0价降至NO和H2O中的-2价,O2为氧化剂;反应中N元素的化合价由NH3中的-3价升至NO中的+2价,NH3为还原剂;1个NH3分子失去5个电子,则该反应中转移电子20e-,用单线桥分析该反应为: 。每消耗1molNH3转移5mol电子,n(NH3)=
。每消耗1molNH3转移5mol电子,n(NH3)=![]() =
=![]() mol,转移电子物质的量为
mol,转移电子物质的量为![]() mol,阿伏伽德罗常数NA=n
mol,阿伏伽德罗常数NA=n![]() mol=
mol=![]() mol-1。
mol-1。
(2)①铝与硝酸汞溶液发生置换反应,反应的化学方程式为:2Al+3Hg(NO3)2=2Al(NO3)3+3Hg,离子方程式为:2Al+3Hg2+=2Al3++3Hg。
②MgCl2溶液与氨水生成Mg(OH)2沉淀的化学方程式为:MgCl2+2NH3·H2O=Mg(OH)2↓+2NH4Cl,离子方程式为:Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+。
(3)洗涤沉淀的目的是洗涤沉淀上吸附的可溶性杂质,Mg(OH)2沉淀上吸附的可溶性杂质为NH4Cl,检验沉淀是否洗净即检验洗涤液中是否含NH4Cl。检验该沉淀已经洗净的操作为:取最后一次洗涤液放入试管中,向该溶液中滴加AgNO3溶液,若无沉淀产生则证明沉淀已洗净。


科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。已知一种合成阿魏酸的反应可表为:

对以上反应说法正确的是
A. 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与Na2CO3、NaOH 、NaHCO3溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体分子中有4种不同化学环境的氢,能消2molNaOH溶液且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 电解熔融氯化镁可制取金属镁
B. 电解饱和食盐水可制取氯气
C. 生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
D. 接触法制硫酸的硫元素主要来源于硫黄或含硫矿石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属在化工生产及日常生活中有着广泛的应用,如铁、铬、镓等在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常招于电镀和制造特种钢。基态Cr原子中,未成对电子数有_______个,Cr3+的价电子排布式为________。
(2)Zn与Ga的第一电离能从大到小的顺序为_________。
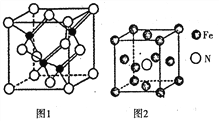
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子)。在GaAs晶体中,距离每个Ga原子最近的As原子有_____个,距离每个As原子最近的As原子有_______个。
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学式为______;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为 _____g.cm-3 (用含a和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,向如图所示的容器(密封的隔板可自由滑动)中加入4LN2和H2的混合气体, 在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5。
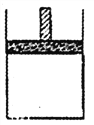
(1)反应前混合气体中V(N2):V(H2)= _______, 反应达到平衡后V(NH3)= _______L,该反应中N2转化率为______。
(2)向平衡后的容器中充入0. 2mol的NH3,一段对间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了 6.44kJ的热量;
①充入NH3时,混合气体的密度将_________,在达到平衡的过程中,混合气体的密度将_______(填“增大”、“减小”或“不变”);反应重新达平衡的混合气体对氢气的相对密度将_____5(填“ >”、“ <”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡 _______;
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当K( N2):V( H2):F( NH3) = 1:3:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式: __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有3份等质量的小苏打,第1份直接与盐酸恰好完全反应;第2份首先加热,使其部分分解后,再与足量盐酸恰好完全反应;第3份首先加热,使其完全分解后,再与足量盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3 >V1 D. V1=V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO![]() ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO![]() 的离子方程式为____________________。
的离子方程式为____________________。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)H2O2的作用是______________。
(3)调pH=8是为了除去__________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
![]() Na2Cr2O7+
Na2Cr2O7+![]() SO2+
SO2+![]() H2O===
H2O===![]() Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+![]() Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________;
②________________________________________________________________________;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道我国科学家最近研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是( )
A. 它耐高温抗氧化
B. 它比钢铁轻、硬,但质地较脆
C. 它没有固定熔点
D. 它是一种新型无机非金属材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com