
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学用到的玻璃仪器除了烧杯、量筒、试剂瓶,还需要_________________。
(2)其操作步骤如下图所示,则如图操作应在下图中的_______(填选项字母)之间。
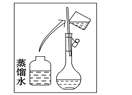
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母)
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
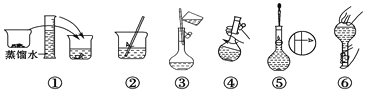
并在下图中选出能正确表示游码位置的选项________(填字母)。
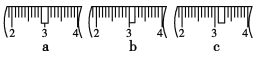
(4)下列操作对所配溶液的浓度大小有何影响?
① 转移完溶液后未洗涤玻璃棒和烧杯,浓度会_______(填“偏大”、“偏小”或“无影响”,下同)。
② 容量瓶中原来有少量蒸馏水,浓度会__________。
③ 以480mL溶液体积计算所需NaOH的质量_________。
④ 未冷却到室温就注入容量瓶定容_________。
【答案】500mL容量瓶、玻璃棒、胶头滴管 C 10.0 c、d c 偏小 无影响 偏小 偏大
【解析】
(1)根据配置一定浓度溶液的步骤:一算、二量、三溶、四冷、五转移、六洗、七加、八定、九摇、十装贴判断所需玻璃仪器;
(2)根据配置溶液的步骤判断;
(3)根据c1V1= c2V2,计算所需氢氧化钠的质量,再根据所需砝码由大到小的顺序判断所需砝码,小于5g的选择游码;
(4)根据c=n/V确定误差。
(1)选取容量瓶的规格应该等于或稍大于配制溶液的体积,实验室没有480mL容量瓶,所以应该选500mL容量瓶,另外根据配置溶液的步骤还需要的玻璃仪器为玻璃棒、胶头滴管;
答案:500mL容量瓶、玻璃棒、胶头滴管
(2)如图所示的操作为移液洗涤后向容量瓶内加水,应在转移与定容之间,即应在④与⑤之间;
答案:C
(3)配制500mL1molL-1NaOH溶液需要氢氧化钠的质量为0.5L×0.5mol/L×40g/mol=10.0g;氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,根据氢氧化钠与烧杯总质量为10.0g+23.1g=33.1g,故应选择20g与10g的砝码,即选择cd;由表中升高可知,最小的砝码为5g,故游码的最大刻度为5g,故小于5g所以游码,所以游码应在3.1g的位置,故选择C;
答案:10.0;c、d;c;
(4)①转移时未洗涤烧杯和玻璃棒,造成溶质的物质的量偏小,配制溶液浓度偏小;
②容量瓶中原来有少量蒸馏水,溶质的物质的量和溶液的体积都不变,所以配制溶液浓度无影响;
③ 以480mL溶液体积计算所需NaOH的质量,造成溶质的物质的量减小,所以配制溶液浓度偏小;
④ 未冷却到室温就注入容量瓶定容,根据热胀冷缩原理,所加水的体积偏小,溶液浓度偏大;
答案:偏小 无影响 偏小 偏大


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
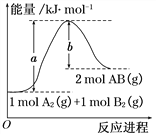
A.每生成2mol AB(g) 共吸收b kJ热量
B.该反应热ΔH = +(a-b) kJ·mol-1
C.反应物的总能量大于生成物的总能量
D.断裂1 mol A—A键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图要求完成实验,并回答问题:
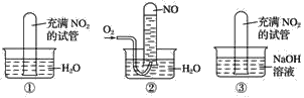
(1)实验①将充满二氧化氮的试管倒立水中,观察到的现象是__________________________。
(2)实验②将充满二氧化氮的试管倒立水中,再通入氧气时观察到的现象是_________。
(3)实验③将充满二氧化氮的试管倒立氢氧化钠溶液中,观察到的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
A.将11.2gFe粉投入到足量稀硫酸中,在标准状况下生成的气体分子数为0.3NA
B.500mL 0.2mol·L-1 CaCl2溶液中,Ca2+和Cl-离子总数为0.2NA
C.标准状况下,22.4 L SO3含有的分子数为NA
D.常温常压下,32 g O2和32 g O3含有的氧原子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下 ①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2 mol NH3,这四种气体的关系表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的( )
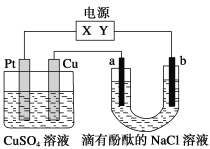
A.Pt为阴极,Cu为阳极
B.电解过程中CuSO4溶液的pH逐渐增大
C.b极的电极反应式是2H++2e-=H2↑
D.Cu极上有6.4gCu析出时,b极产生2.24L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | a | c | d | e | f | g | |
3 | b | h | i | j | k |
(1)这些元素中非金属性最强的单质是_________,最高价氧化物对应水化物酸性最强的是_________,最高价氧化物对应水化物碱性最强的是_________。
(2)表中k的氢化物的化学式为_____,它的还原性比j的氢化物还原性_______(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性_______(填“强”或“弱”)。
(3)e单质为________,其结构式为________________。
(4)用电子式表示h与k构成化合物的形成过程________________
(5)写出i的氧化物与强碱溶液反应的离子方程式________________
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是____(填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com