
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
A.将11.2gFe粉投入到足量稀硫酸中,在标准状况下生成的气体分子数为0.3NA
B.500mL 0.2mol·L-1 CaCl2溶液中,Ca2+和Cl-离子总数为0.2NA
C.标准状况下,22.4 L SO3含有的分子数为NA
D.常温常压下,32 g O2和32 g O3含有的氧原子数均为2NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)从实验装置上看,图中有一处仪器未画出的是_____________________。
(2)在其他操作正确的前提下,提高中和热测定准确性的关键是____________。大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”或“无影响”)
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将______(填“偏大”、“偏小”、“不变”);原因是___________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的生成1 mol液态水时放出热量的数值_______________(填“偏大”、“偏小”、“不变”)。
(5)实验中NaOH过量的目的是___________。
(6)若某同学利用上述装置做实验有些操作不规范,造成测得中和热偏小,请分析可能原因(________)。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.用量筒中的氢氧化钠溶液倒入小烧杯时动作缓慢
C.在量取盐酸时仰视读书
D.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验是中学化学的重要实验。
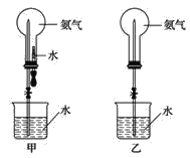
(1)实验室中常用图甲装置进行NH3的喷泉实验。用该装置完成喷泉实验的操作方法是_________。
(2)若用图乙装置进行NH3的喷泉实验,打开止水夹后,烧杯中的液体不能进入烧瓶。请写出引发喷泉实验的一种操作方法:____________。
(3)若将图甲装置中胶头滴管和烧杯中液体改为NaOH溶液,能用改动后的甲装置进行喷泉实验的一组气体是_________(填字母)。
A.HCl和CO2 B.Cl2和CO C.O2和SO2 D.NO2和NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
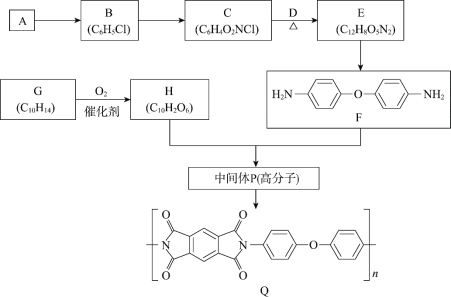
【题目】聚酰亚胺是一类非常有前景的可降解膜材料,其中一种膜材料Q的合成路线如下。
已知:i.![]() +
+![]()
![]()
![]() +
+![]()
ii.![]() +NaOH
+NaOH![]()
![]() +
+![]()
(1)A是芳香烃,A![]() B的化学方程式是________。
B的化学方程式是________。
(2)B转化为C的试剂和条件是________。
(3)C中所含的官能团的名称是________。
(4)D可由C与KOH溶液共热来制备,C与D反应生成E的化学方程式是________。
(5)E![]() F的反应类型是________。
F的反应类型是________。
(6)G与A互为同系物,核磁共振氢谱有2组峰,G![]() H的化学方程式是________。
H的化学方程式是________。
(7)H与F生成中间体P的原子利用率为100%,P的结构简式是________(写一种)。
(8)废弃的膜材料Q用NaOH溶液处理降解后可回收得到F和_______(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学用到的玻璃仪器除了烧杯、量筒、试剂瓶,还需要_________________。
(2)其操作步骤如下图所示,则如图操作应在下图中的_______(填选项字母)之间。
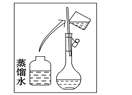
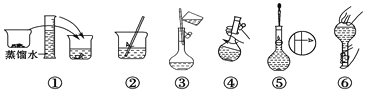
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母)
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
并在下图中选出能正确表示游码位置的选项________(填字母)。
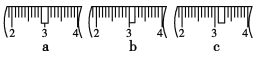
(4)下列操作对所配溶液的浓度大小有何影响?
① 转移完溶液后未洗涤玻璃棒和烧杯,浓度会_______(填“偏大”、“偏小”或“无影响”,下同)。
② 容量瓶中原来有少量蒸馏水,浓度会__________。
③ 以480mL溶液体积计算所需NaOH的质量_________。
④ 未冷却到室温就注入容量瓶定容_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体二氧化硫、一氧化碳、一氧化氮,分子数之比为________;氧原子数之比为________;相同条件下的体积之比为__________。
(2)标准状况下,1.7g氨气的体积是________,与其含有相同数目氢原子的硫化氢的体积是__________。
(3)某气体氧化物的化学式为RO2,标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_________,R的相对原子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com