
【题目】下列说法中正确的是
A. 阿伏加德罗常数就是指6.02×1023
B. 1 mol 任何物质都约含有6.02×1023个分子
C. 3.01×1023个Na+的物质的量是0.5 mol
D. 2 mol SO42-约含有1.204×1023个SO42-
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CO2 的质量为_____克,其中含有 CO2 分子_____个,在标准状况下的体积是_____升。
(2)标况下,1.92 g 某气体的体积为 672 mL,则此气体的相对分子质量为_____。
(3)已知某硫酸溶液的密度为 1.84 g/cm3,质量分数为 98%,则该硫酸的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]∶n(NH4Cl)为________。
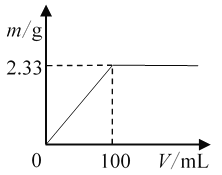
(2)另一份固体混合物中NH与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
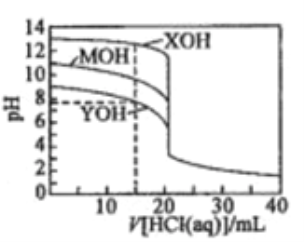
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 32 g O2和O3的混合气体所含原子数为NA
B. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
C. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
D. 在25℃、101kPa下,2 mol氧气和氢气的混合气体的体积约为44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.蔗糖和葡萄糖互为同分异构体
B.淀粉、纤维素都是天然高分子化合物
C.蔗糖与稀硫酸共热后的溶液中加入新制的氢氧化铜,加热有红色沉淀
D.在常温下,淀粉遇碘离子变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
D. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Al与NaOH溶液能够形成原电池,写出该电池的负极反应式________。Al的原子结构示意图为_______。不能电解A1的氯化物来生产Al,原因是________;
(2)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上用HF、Na2CO3和A1(OH)3制备冰晶石。写出制备冰晶石的化学方程式________。上述反应不能在玻璃容器中反应,其原因是__________(用化学方程式表示)。
(3)明矾[KA1(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式_______________。
(4)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生气体体积相等(同温同压)。则该合金中铁、硅的质量之比为________(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
(5)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式_____________;
②在化学上,含包还原剂的还原能力用“有效氢”表示,“有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com