
| 实验步骤 | 实验现象 | 实验结论 |
 | 溶液变为黄色 | 氧化性:Cl2>Br2 |
 | 溶液变为黄色 | 氧化性: Br2>I2 |
 | 溶液的颜色由黄色变为蓝色 |
分析 (1)步骤①溶液变为黄色是氯气与溴离子发生氧化还原反应,生成单质溴;
(2)检验②中所得黄色溶液含I2的另一种方法是萃取的方法;
(3)①中所得溶液中可能含有过量的氯气,对后继氧化性强弱的比较产生干扰.
解答 解:(1)步骤①溶液变为黄色是氯气与溴离子发生氧化还原反应,生成单质溴,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,故答案为:2Br-+Cl2=Br2+2Cl-;
(2)检验②中所得黄色溶液含I2的另一种方法是萃取的方法,具体操作向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色,故答案为:向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色;
(3)①中所得溶液中可能含有过量的氯气,对后继氧化性强弱的比较产生干扰,故答案为:不能;①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
点评 本题为探究题和实验设计题,用以比较卤素单质的氧化性强弱,注意本题中要排除干扰因素的存在,掌握氧化还原反应有关知识以及卤素的性质是解答的关键,综合考查了学生灵活运用知识的能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
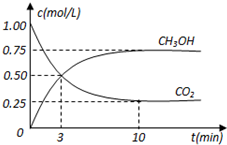 在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 280 | B. | 202 | C. | 124 | D. | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物中含有极性共价键(填“极性”或“非极性”).
,该化合物中含有极性共价键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
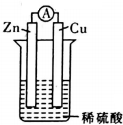 在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片流向铜片 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 经过一段时问工作后'电解液的pH值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
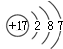 .
.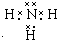 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com