
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
A.放电时正极附近溶液的碱性增强
B.放电时每转移3mol电子,正极有1molK2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为Fe(OH)3-3e-+H2OFeO42-+5H+
【答案】D
【解析】
试题分析:A.放电时,K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为2FeO42- + 6e- + 8H2O ═ 2Fe(OH)3 + 10OH-,正极附近溶液的碱性增强,A项正确;B.根据电极反应:2FeO42- + 6e- + 8H2O ═ 2Fe(OH)3 + 10OH-,则放电时每转移3 mol电子,正极有1mol K2FeO4被还原,B项正确;C.根据“正接正,负接负”原则,放电时负极Zn被氧化,则充电时锌极与外电源负极相连,C项正确;D.充电时阳极反应为Fe(OH)3+5OH—-3e-=FeO42-+4H2O,D项错误;答案选D。


科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是( )
A.Fe2+、Al3+、ClO﹣、Cl﹣
B.K+、Cu2+、OH﹣、NO3﹣
C.NH4+、Na+、Br﹣、SO42﹣
D.Mg2+、H+、SiO32﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) >c(Cl-)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你回答下列问题:
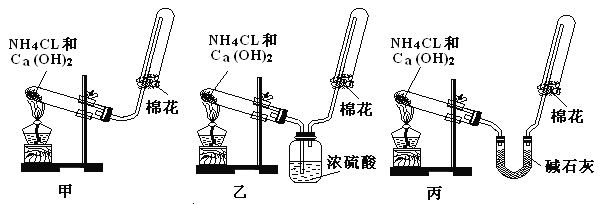
(1)三位同学制取氨气的化学方程式为:___________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是_______ 填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)__________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_______ (填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?_______ (填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( )

A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com