
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
分析 A.醋酸溶液中存在电离平衡,加入醋酸钠会抑制醋酸电离;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,溶液中铵根离子水解,溶液呈酸性;
C.硫化氢为弱电解质,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度;
D.根据pH=-lg[c(H+)]计算出该盐酸中氢离子浓度,然后再根据pH=-lg[c(H+)]计算出混合液的pH.
解答 解:A.稀醋酸溶液中存在平衡:CH3COOH?CH3COO-+H+,加入醋酸钠,溶液中CH3COO-离子浓度增大,抑制醋酸的电离,故A错误;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,硝酸和硝酸铵的导电能力几乎相等,故B错误;
C.硫化氢为弱电解质,部分电离,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱,故C错误;
D.pH=1的盐酸中c(H+)=10-1mol/L,与等体积的水混合后氢离子浓度为:10-1mol/L×0.5=5×10-2mol/L,则混合液的pH=-lg[c(H+)]=-lg5×10-2=2-lg5≈1.3,故D正确;
故选D.
点评 本题考查盐类水解、溶液导电性、弱电解质的电离平衡及其影响因素,难度不大,注意电解质溶液中离子浓度大小的比较分析.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:解答题
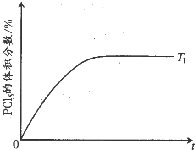
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 在研究原子结构的过程中建立起的各种模型属于思维模型 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com