
��ѧ����ᡢ����������ء��������������ʵ�Ľ�����ȷ����
| ѡ�� | �������ʵ | ���� |
| A | ���ȵ��ռ���Һϴȥ���� | Na2CO3��ֱ�Ӻ����۷�Ӧ |
| B | Ư���ڿ����о��ñ��� | Ư���е�CaCl2 ������е�CO2��Ӧ����CaCO3 |
| C | ʩ��ʱ����ľ��(��Ч�ɷ�ΪK2CO3)������NH4Cl���ʹ�� | K2CO3��NH4Cl��Ӧ���ɰ����ή�ͷ�Ч |
| D | FeCl3��Һ������ͭ��ӡˢ��·������ | FeCl3�ܴӺ���Cu2������Һ���û���ͭ |
C
�������������A���ε�ˮ�ⷴӦ�����ȷ�Ӧ�����������¶ȣ��ٽ��ε�ˮ�⣬��Һ�ļ��Ը�ǿ��������ȵĴ�����Һ����ϴȥ���ۡ�������̼���ƿ�������ֱ�ӷ�Ӧ������B��Ư���ڿ����о��ñ��ʣ�����Ϊ��Ч�ɷ�Ca(ClO)2�ᷢ����Ӧ������HClO���ȶ������շֽ����HCl������������C����ʩ��ʱ��ľ�ң���Ч�ɷ�ΪK2CO3����NH4Cl���ʹ�ã�����ߵ�ˮ��������ٽ���ʹNԪ����������ʽ�ݳ������Ч�ή�͡���ȷ��D��FeCl3��Һ������ͭ��ӡˢ��·�������������Ϊ���߷�����Ӧ�����Ȼ��������Ȼ�ͭ���Ѷ����Cu��ʴ��������
���㣺�����ε�ˮ�⼰Ӧ�õ�֪ʶ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���0.1mol/L�Ĵ����0.1mol/L��NaOH��Һ�������ϣ�������Һ�в����ڵĹ�ϵ��
| A��c(OH��)��c(H��) |
| B��c(CH3COOH)��c(CH3COO��) |
| C��c(Na��)��c(CH3COO��) |
| D��c(Na��)+ c(H��)= c(CH3COO��)+ c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ�����и���Һ���й��������ʵ���Ũ�ȹ�ϵ��ȷ����
| A����0.1 mol��L��1Na2S��Һ�У�2c(Na��) =c(S2��)��c(HS��) ��c(H2S) |
| B��pH=2�Ĵ�����Һ��pH=12��NaOH��Һ�������ϣ� c(Na��)+ c(H��)= c(OH��)+c(CH3COO��) |
| C����0.1 mol��L��1������0.1 mol��L��1K2CO3��Һ�������ϣ� c(K��) ��c(Cl��)��c(HCO3��)��c(OH��)��c(H��) |
| D����0.1 mol��L��1NH4HSO4��Һ�еμ�NaOH����Һǡ�ó����ԣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
50��ʱ�����и���Һ�У����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����
| A��pH=4�Ĵ����У�c��H+��=4.0mol��L-1 |
| B������С�մ���Һ�У�c��Na+��= c��HCO3-�� |
| C������ʳ��ˮ�У�c��Na+��+ c��H+��= c��Cl-��+c��OH-�� |
| D��pH=12�Ĵ�����Һ�У�c��OH-��=1.0��10-2mol��L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���бȽ��У���ȷ����
| A�����µ����ʵ���Ũ����Һ�У�HF��HCN���룬��NaF��Һ��pH��NaCN��Һ�� |
| B��0.2 mol/L NH4Cl��Һ��0.1 mol/LNaOH��Һ�������Ϻ�c(NH4+)��c(Cl��)��c(Na+)��c(OH��)��c(H+) |
| C�����ʵ���Ũ����ȵ�H2S��NaHS�����Һ�У�c(Na+)= c(S2��)+ c(HS��)+ c(H2S) |
| D��ͬŨ�ȵ�������Һ�У���NH4Al(SO4) 2��NH4Cl��CH3COONH4��NH3��H2O��c(NH4+)�ɴ�С��˳���Ǣ٣��ڣ��ۣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ˮ������֮Դ��2014���ҹ���ѧ���״����㵽ˮ�����ŴصĿռ�ȡ��ͼ��ģ����ͼ�����й���ˮ��˵����ȷ����
| A��ˮ��������� | B����ȼ���ǿ���ȼ�յ�ˮ |
| C����������Ԫ��ֻ�����ˮ | D��0��ʱ�����ܶȱ�Һ̬ˮ���ܶȴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������Һ������Ũ�ȵĹ�ϵһ����ȷ����
A�� �� �� ��Һ�У� ��Һ�У�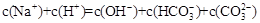 |
B��һԪ����MOH��Ӧ����MCl��Һ�У� |
C�������ʵ�����һԪ����HX�������KX�Ļ����Һ�У� |
D��pH=3��һԪ��HX��pH=11��һԪ��MOH�������ϣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���20mL0.2mol/LH2A��Һ�еμ�0.2mol/LNaOH��Һ���й��������ʵ����仯����ͼ�����Т����H2A�������HA-�������A2-��������ͼͼʾ�жϣ�����˵��������ǣ� ��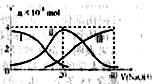
A����V��NaOH��=20mLʱ����Һ������Ũ�ȴ�С��ϵ��c(Na+)>c(HA����>c(H+)> c(A2��)>c(OH��)
B���������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ�Ĵ�
C��NaHA��Һ�У�c(OH-)��c(A2�C)��c(H+)��c(H2A)
D����Na2A��Һ����ˮ�Ĺ����У�pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��0.1 mol/L��Na2CO3��Һ�У����й�ϵ��ȷ����(����)
A��c(Na��)��2c(CO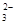 ) ) | B��c(OH��)��2c(H��) |
C��c(HCO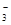 )>c(H2CO3) )>c(H2CO3) | D��c(Na��)<c(CO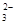 )��c(HCO )��c(HCO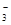 ) ) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com