
【题目】海洋是资源宝库。下图是工业上对海水的一种综合利用的流程图:

请回答下列问题:
(1) 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和_________。
(2) 若粗盐中含有Ca2+、Mg2+、SO42-三种杂质离子。精制提纯时,备用的除杂试剂有:A.盐酸,B.Na2CO3溶液,C.NaOH溶液,D.BaCl2溶液。请你正确排列加入试剂的顺序:NaOH溶液、_______、_______、_______(填编号)。
(3) 用如图电解食盐水,石墨电极上产生的气体为_______;在铁棒周围的溶液里滴加酚酞试剂,溶液变_______色;小烧杯中NaOH溶液的作用是(用化学方程式表示):______________。

(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为_________________(填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.过滤
【答案】玻璃棒 D B A 氯气( Cl2) 红 Cl2+NaOH=NaCl+NaClO+H2O BCD
【解析】
(1)在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和玻璃棒,玻璃棒在过滤操作中起到引流的作用, 因此答案是:玻璃棒。
(2)粗盐中含有Ca2+、Mg2+、SO42-三种杂质离子。精制提纯时:先加NaOH溶液除去Mg2+、再加BaCl2溶液除去SO42-、再加Na2CO3溶液除去Ca2+和过量Ba2+;过滤后加入盐酸除去过量的NaOH和碳酸钠;加入试剂的顺序:D;B;A。
(3) 用如图电解食盐水,石墨电极为阳极,电极上产生的气体为Cl2;铁棒与电源负极相连,发生的反应为:2H2O+4e-= H2![]() +2OH-,如果在周围的溶液里滴加酚酞试剂,溶液变红色;小烧杯中NaOH溶液的作用是吸收氯气,反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O。答案:氯气;红;Cl2+2NaOH=NaCl+NaClO+H2O。
+2OH-,如果在周围的溶液里滴加酚酞试剂,溶液变红色;小烧杯中NaOH溶液的作用是吸收氯气,反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O。答案:氯气;红;Cl2+2NaOH=NaCl+NaClO+H2O。
(4)先通过蒸发去除多余的水分,然后冷却结晶,再过滤得到晶体,进行洗涤干燥。答案:BCD。


科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁发生电化学腐蚀的正极反应式:Fe -2e- == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)往A溶液中分别滴入几滴KSCN溶液,溶液的颜色__________,
(2)根据上述过程写出有关反应的离子方程式:Fe3O4→A _________________,A→B ___________。
(3)向B溶液中加入NaOH溶液,可看到的现象是_______________________________________,此过程中发生的氧化还原反应化学方程式为__________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带路”为中国化工企业开辟了新的国际市场,能源环保是基础。在能源领域科学家提出构想——富集空气中的CO2,并使之与H2反应生成可再生能源甲醇.流程如下:
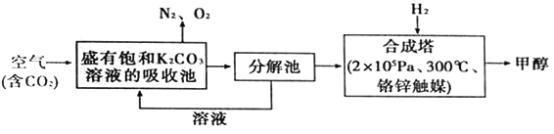
(1)在合成塔中,若有4400gCO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式________________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2在不同催化剂作用下发生反应I、反应II、反应III,相同时间内CO2的转化率随温度变化如图1所示:
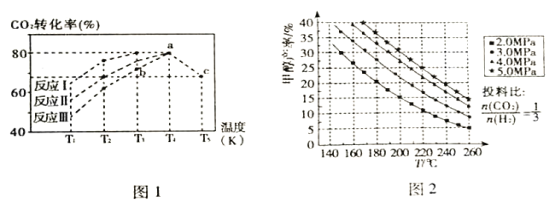
①催化效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)______v(逆) (填“>”、“=”或“<”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
(3)选取合适的催化剂发生上述反应,测得甲醇的产率与反应温度、压强的关系如图2。
④分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为________;将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将_______(填“增大”、“减小”或“不变”)。
⑤200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量______g(用含a、V的代数式表示)。
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)==PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容。试根据标签上的有关数据回答下列问题:
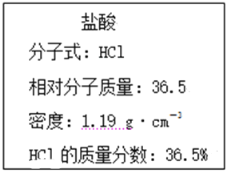
(1)该浓盐酸中HCl的物质的量浓度为_______________。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol·L-1的稀盐酸,需要量取上述___________mL浓盐酸进行配制。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业从废铅酸蓄电池的渣泥(主要成分为PbSO4、PbO2)回收铅。RSR 工艺的主要流程如下:
![]()
(1)铅酸蓄电池放电时总反应为:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
负极反应:________。
(2)向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3。
①用化学平衡移动原理解释其原因:________。
②工业上常用NaHCO3溶液代替Na2CO3溶液,将PbSO4转化为PbCO3。PbSO4与NaHCO3溶液或Na2CO3溶液不同物质的量比时,PbSO4的转化率见下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 98 | 98 | 98 |
依据上表数据,物质的量比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是________。
③上述反应除生成PbCO3外,还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],二者受热都易分解生成PbO。通过实验确定产物中含有2PbCO3·Pb(OH)2,则该实验操作及现象是________;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是________。
(3)渣泥中加入Na2SO3溶液,利用其性质是________。
(4)H2SiF4溶液溶解PbCO3的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
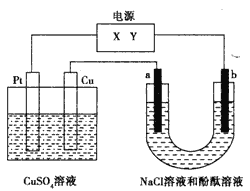
A. Pt为阴极,Cu为阳极
B. b极的电极反应式是2H++2e-=H2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜,阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
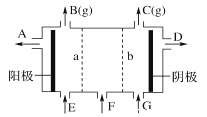
A. 阴极反应式为4OH--4e-=2H2O+O2↑ B. 从A口出来的是NaOH溶液
C. b是阳离子交换膜,允许Na+通过 D. Na2SO4溶液从G口加入
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com