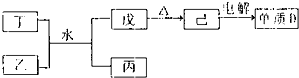
A元素的单质常温常压下是最轻的气体,说明A为H元素;B元素所形成化合物种类最多说明B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,说明C是N元素,丙是硝酸铵,D元素的离子半径是同周期元素形成的简单离子中最小的.结合转化关系可知,D为Al;E为S;
(1)转化关系中己为Al
2O
3,戊为Al(OH)
3,丙为NH
4NO
3,丁+乙+H
2O→Al(OH)
3+NH
4NO
3;说明乙丁为NH
3和铝盐;
①丁与乙和水反应生成戊和丙的离子方程式为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;物质己为Al
2O
3电解得到单质D为Al的化学方程式为:2Al
2O
3
4Al+3O
2↑;
故答案为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;2Al
2O
3
4Al+3O
2↑;
②0.1mol/L的丙溶液是NH
4NO
3中,铵根离子水解呈酸性,所含离子浓度由大到小排列顺序为:C(NO
3-)>C(NH
4+)>C(H
+)>C(OH
-);常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,依据溶液中电荷守恒分析判断;氢氧根离子浓度等于氢离子浓度,所以溶液至中性时C(NO
3-)═C(NH
4+),所以应向溶液中加入一定量的乙的水溶液至中性;
故答案为:C(NO
3-)>C(NH
4+)>C(H
+)>C(OH
-);溶液PH=7;
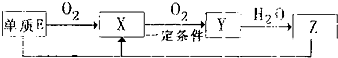
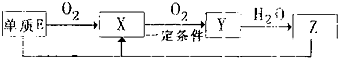
(2)依据转化关系判断:E为S;X为SO
2;Y为SO
3;Z为H
2SO
4;单质E为S,与化合物Z为浓H
2SO
4在一定条件下反,应生成X为SO
2和水,反应化学方程为:S+2H
2SO
4(浓)

3SO
2↑+2H
2O;
由A、B、C、D、E5种元素分别为:H、C、N、Al、S;其中的两种元素可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为:C
2H
6、或N
2H
4;
故D答案为:C
2H
6或N
2H
4;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,证明无色气体为NO,红棕色气体为NO
2;在一定条件下,2L的该无色气体与0.5L的氧气相混合,一氧化氮剩余1L,生成二氧化氮体积1L,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生的反应为NO+NO
2+2NaOH=2NaNO
2+H
2O,所以生成的氮元素的含氧酸盐的化学式为:NaNO
2;
故答案为:NaNO
2;
分析:A元素的单质常温常压下是最轻的气体,说明A为H元素;B元素所形成化合物种类最多说明B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,说明C是N元素,丙是硝酸铵,D元素的离子半径是同周期元素形成的简单离子中最小的.结合转化关系可知,D为Al;E为S;
(1)转化关系中己为Al
2O
3,戊为Al(OH)
3,丙为NH
4NO
3,丁+乙+H
2O→Al(OH)
3+NH
4NO
3;说明乙丁为NH
3和铝盐;
①丁与乙和水反应生成戊和丙的离子方程式为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;物质己为Al
2O
3电解得到单质D为Al的化学方程式为:2Al
2O
3
4Al+3O
2↑;
②0.1mol/L的丙溶液是NH
4NO
3中,铵根离子水解呈酸性,所含离子浓度由大到小排列顺序为:C(NO
3-)>C(NH
4+)>C(H
+)>C(OH
-);常温下,为使丙溶液硝酸铵溶液中电离的阴、阳离子浓度相等,依据溶液中电荷守恒分析判断;氢氧根离子浓度等于氢离子浓度,所以溶液至中性时C(NO
3-)═C(NH
4+),所以应向溶液中加入一定量的乙的水溶液至中性;
(2)依据转化关系判断:E为S;X为SO
2;Y为SO
3;Z为H
2SO
4;单质E为S,与化合物Z为浓H
2SO
4在一定条件下反,应生成X为SO
2和水,反应化学方程为:S+2H
2SO
4(浓)

3SO
2↑+2H
2O;
由A、B、C、D、E5种元素分别为:H、C、N、Al、S;其中的两种元素可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为:C
2H
6、或N
2H
4;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,证明无色气体为NO,红棕色气体为NO
2;在一定条件下,2L的该无色气体与0.5L的氧气相混合,一氧化氮剩余1L,生成二氧化氮体积1L,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生的反应为NO+NO
2+2NaOH=2NaNO
2+H
2O,所以生成的氮元素的含氧酸盐的化学式为:NaNO
2;
点评:本题考查了元素判断和物质推断的方法,转化关系的应用,主要考查原子结构和元素推断,物质性质的判断,电解冶炼铝的原理,溶液中电荷守恒、离子浓度大小的比较等.

 4Al+3O2↑;
4Al+3O2↑; 4Al+3O2↑;
4Al+3O2↑; 3SO2↑+2H2O;
3SO2↑+2H2O; 4Al+3O2↑;
4Al+3O2↑; 3SO2↑+2H2O;
3SO2↑+2H2O;

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案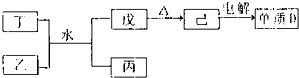
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2 2NO2
2NO2