
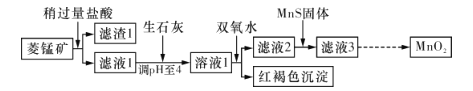
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等杂质]为原料制取二氧化锰.其工艺流程示意图如下图所示:
已知生成氢氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度均为0.1mol·L—1
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是__________;盐酸溶解MnCO3的化学方程式是____________________________。
(2)向溶液1中加入双氧水时.发生反应的离子方程式是_________________。
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是_________________________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是______。
【答案】增大接触面积,提高反应速率和浸取率 MnCO3+2HCl=MnCl2+CO2↑+H2O 2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+ MnS+Cu2+=Mn2++CuS 4H2O Cl2↑ 5MnO2 8H+ Mn2+-2e-+2H2O=MnO2+4H+ 其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电)
【解析】
用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,需要分离除杂,结合流程图分析各步所加试剂及反应。菱锰矿加稍过量盐酸二氧化硅不反应,滤渣1则为SiO2,加双氧水氧化Fe2+,调pH至4,沉淀Fe3+,加MnS固体沉淀Cu2+,最后得到MnO2,以此解题。
菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在pH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,经系列转化得到MnO2,
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率和浸取率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在pH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)MnS与氯化铜反应转化更难溶的CuS,反应离子方程式为:MnS+Cu2+=Mn2++CuS;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+;
②Mn2+、Cl-都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电)。


科目:高中化学 来源: 题型:
【题目】物质的量在计算中有广泛的应用,请完成下列各小题:
(1)9gH2O与__________gH3PO4所含分子数相等。
(2)固体X在一定条件下加热分解,其方程式为2X![]() Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为__________。
Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为__________。
(3)在同温同压下,6.5g某气体A的分子数与7gC2H4的分子数相等,则气体A在标准状况下的密度为__________gL-1(结果保留三位有效数字)。
(4) b%的硫酸溶液与4b%的硫酸溶液等质量混合后,所得溶液中溶质的质量分数__________(填“>”、“<”或“=”,下同)2.5b%;如果等体积混合,所得溶液中溶质的质量分数__________2.5b%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。
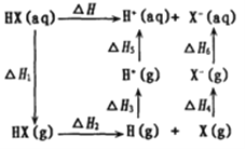
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.将1 mol/L NaAlO2和1.5 mol/L的HCl等体积互相均匀混合:6AlO+9H++3H2O=5Al(OH)3↓+Al3+
B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2![]() +Ba2++2OH-=BaCO3↓+2H2O
+Ba2++2OH-=BaCO3↓+2H2O
C.Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
D.在过氧化氢里加入酸性的高锰酸钾:2![]() +3H2O2 + 6H+ =2Mn2+ + 4O2↑+ 6H2O
+3H2O2 + 6H+ =2Mn2+ + 4O2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。完成下列填空:
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为_______.该反应的氧化剂是_____,反应产生的气体可用_______吸收.
②As2S3和HNO3有如下反应:__As2S3+__NO3-+_____=__H3AsO4+__S+__NO2↑+_______
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为________.
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和![]() 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___.若5mol Cl2参加反应,转移电子数为______________(用NA表示阿伏伽德罗常数)
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___.若5mol Cl2参加反应,转移电子数为______________(用NA表示阿伏伽德罗常数)
(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为______________________;若反应过程中转移了0.3mol电子,则氧化产物的质量是______g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目________,题干中反应改写成离子方程式是____。
(2)电解食盐水的过程中,被还原的元素是____________,氧化产物是______。
Ⅱ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________。
(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为____mol,被Fe2+还原的O2的物质的量为_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com