
【题目】下列关于合金的叙述中正确的是
A.合金不具有金属光泽 B.金属和非金属之间不可能形成合金
C.生铁和钢都是铁的合金 D.钛合金比铁合金使用更广泛
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】1mol乙烯与氯气发生加成反应,反应完全后再与氯气发生取代反应,整个过程中氯气最多消耗
A. 3mol B. 4mol C. 5mol D. 6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写):________________。
(2)下列操作中可能使所测NaOH的质量分数偏低的是__________。
a.滴定操作中,锥形瓶残留少量蒸馏水
b.B步操作中,装入烧碱溶液之前未用待测液润洗
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
(3)该烧碱样品纯度的计算式为______________________。
II.以下是FeSO4·7H2O的实验窒制备流理图。
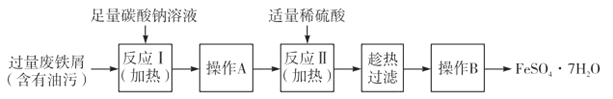
根据题意完成下列填空:
(1)反应1需要加热数分钟,其原因是 ;操作A为 。
(2)测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。KMnO4溶液应盛装在 滴定管中,发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做焰色反应实验用的铂丝,每试验一种样品后都必须
A. 用水洗涤2~3次后再使用
B. 用盐酸洗涤后,经蒸馏水冲洗,方可使用
C. 用滤纸擦干后才可使用
D. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为 ,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
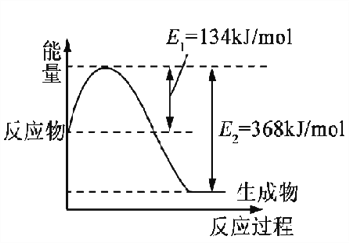
已知:① N2(g)+O2(g)=2NO(g) △H= +179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H= -112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: ____________________
(2)将0.20 mol NO2和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如下图所示。
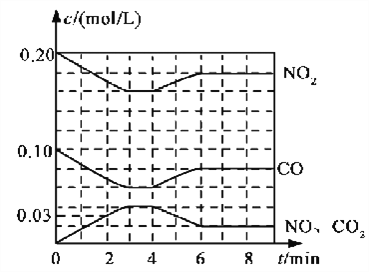
①下列说法正确的是___________(填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)=__________mol·L-1·min-1
③第4 min时改变的反应条件为__________________。
④计算反应在第6 min时的平衡常数K=________。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届宁夏石嘴山三中高三第二次适应性考试】
有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表示意图的一部分。
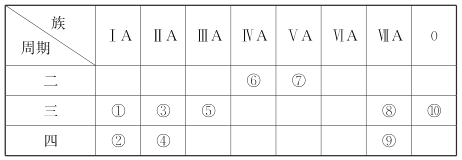
请回答下列问题:
(1)元素③~⑦中,原子半径最大的是____(填元素符号)。
(2)元素①~⑩中,最高价氧化物对应的水化物中酸性最强的是____(填化学式,下同),呈两性的氢氧化物是____。
(3)元素⑦的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com