
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
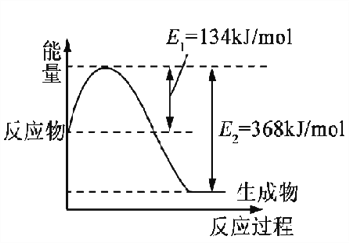
已知:① N2(g)+O2(g)=2NO(g) △H= +179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H= -112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: ____________________
(2)将0.20 mol NO2和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如下图所示。
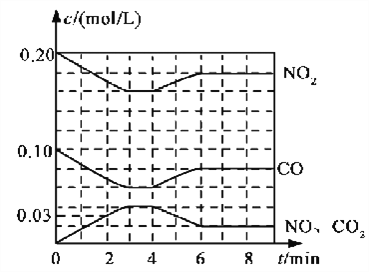
①下列说法正确的是___________(填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)=__________mol·L-1·min-1
③第4 min时改变的反应条件为__________________。
④计算反应在第6 min时的平衡常数K=________。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将________移动(填“正向”、“逆向”或“不”)。
【答案】2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) ΔH=-759.8 kJ/molc0.015升温1/36(或0.028)逆向
N2(g) + 2CO2(g) ΔH=-759.8 kJ/molc0.015升温1/36(或0.028)逆向
【解析】
(1)①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol;②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol;依据图象书写得到热化学方程式③NO2(g)+CO(g)=CO2(g)+NO(g)△H=(134-368)KJ/mol=-234KJ/mol;由盖斯定律②+③-①得到反应的热化学方程式:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-759.8KJ/mol;
(2)图象分析可知反应为:NO2(g)+CO(g)NO(g)+CO2(g);①a.反应前后气体体积不变,当容器内的压强不发生变化,不能说明该反应达到平衡,故a错误;b.当向容器中加再充入0.20mol NO时,平衡向逆反应方向移动,K值不变,故b错误;c.升高温度后,K值减小,说明平衡逆向进行,NO2的转化率减小,故c正确;d.向该容器内充入He气,总压增大,气体分压不变,所以反应反应速率不变,故d错误;故选c;
②产物NO在0~2min时平均反应速率v(NO)=![]() =0.015mol/Lmin;
=0.015mol/Lmin;
③图象分析可知4min后二氧化氮和一氧化碳浓度增大,一氧化氮和二氧化碳浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化;
④依据图象分析,6min时平衡状态下物质的浓度为c(NO2)=0.18mol/L,c(CO)=0.08mol/L,c(NO)=0.02mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,NO2(g)+CO(g)![]() NO(g)+CO2(g),K=
NO(g)+CO2(g),K=![]() =
=![]() ;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=
;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=![]() =
=![]() >K,平衡逆向进行。
>K,平衡逆向进行。


科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。
H++A2-。
⑴NaHA溶液__________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定正确的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)= _________mol/L
II.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_______________,所得溶液中c(H+)-c(OH-)=_______________(填写表达式)
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
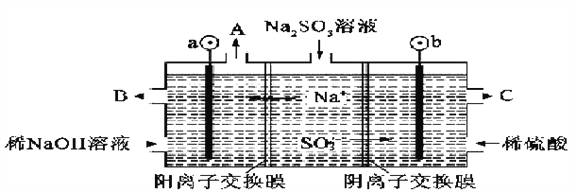
①图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②![]() 放电的电极反应式为_______________。
放电的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中正确的是
A.合金不具有金属光泽 B.金属和非金属之间不可能形成合金
C.生铁和钢都是铁的合金 D.钛合金比铁合金使用更广泛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法鉴别下列物质:( )
①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是
A. ①②③④ B. ③④②①
C. ④①②③ D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法正确的是
A. 自然界中不存在游离态的硫
B. 二氧化硫的排放会导致光化学烟雾和酸雨的产生
C. 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了二氧化硫的漂白性
D. 浓硫酸可用来干燥SO2、CO、Cl2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧化铁砷合物)高温超导”材料研究上取得了重要成果,给研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)Fe在周期表的位置为
(2)氟、氧、砷三种元素中电负性最小的是__________(用元素符号填空)。
(3)氧的最简单氢化物键角为 ,砷的最简单氢化物分子空间构型为 。
(4)FeCl3晶体易溶于水,乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因: 。
(5)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图。

①已知CN-与N2结构相似,1molCN-中π键数目为 。
②上述沉淀溶解过程的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝箔包装0.1mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到气体的为 ( )
A. O2和H2的混合气体 B. 0.05molH2
C. 小于0.05molH2气体 D. 大于0.05molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com