
【题目】I.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写):________________。
(2)下列操作中可能使所测NaOH的质量分数偏低的是__________。
a.滴定操作中,锥形瓶残留少量蒸馏水
b.B步操作中,装入烧碱溶液之前未用待测液润洗
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
(3)该烧碱样品纯度的计算式为______________________。
II.以下是FeSO4·7H2O的实验窒制备流理图。
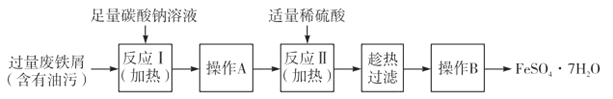
根据题意完成下列填空:
(1)反应1需要加热数分钟,其原因是 ;操作A为 。
(2)测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。KMnO4溶液应盛装在 滴定管中,发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。[
【答案】
Ⅰ.(1)CABDE; (2)bd; (3)![]() ×100%;
×100%;
Ⅱ.(1)促进Na2CO3水解,溶液的碱性增强,去污能力增强;过滤
(2)酸式;MnO4-+5Fe2++8H+=Mn2++5Fe3++4H20;93%;
【解析】
试题分析:Ⅰ.(1)在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂,将物质的量浓度为c的标准硫酸溶液装入酸式滴定管.调整液面记下开始读数为V1mL,在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E,故答案为:C、A、B、D、E;
(2)a.滴定操作中,锥形瓶残留少量蒸馏水,对实验结果无影响,错误;b.B步操作中,装入烧碱溶液之前未用待测液润洗,导致氢氧化钠溶液的浓度偏低,结果偏低,正确;c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗,导致硫酸浓度偏小,消耗硫酸的体积偏大,结果偏高,错误;d.读取硫酸体积时,开始时仰视读数,结束时俯视读数,导致硫酸的体积偏小,结果偏低,正确;故选bd;
(3)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×cmol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2c(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:2c(V2-V1) × 10-3mol × ![]() = 2c(V2-V1) × 10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,则该烧碱样品的纯度为:
= 2c(V2-V1) × 10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,则该烧碱样品的纯度为:![]() ×100%=
×100%=![]() ×100%;故答案为:
×100%;故答案为:![]() ×100%;
×100%;
II.(1)反应1需要加热数分钟,可以促进Na2CO3水解,溶液的碱性增强,去污能力增强;分离固体和液体通常用过滤的方法,过滤所得固体表面有可溶性杂质,通过洗涤除去,所以操作A为过滤,故答案为:促进Na2CO3水解,溶液的碱性增强,去污能力增强;过滤;
(2)酸性高锰酸钾溶液具有强氧化性,应该选用酸式滴定管盛放,酸性高锰酸钾溶液能将亚铁离子氧化成铁离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,根据电子得失守恒有
5 FeSO47H2O~KMnO4,
5×278g 1mol
m(FeSO47H2O) 0.2000mol/L×0.02L
所以(FeSO47H2O)=0.2000mol/L×0.02L×278g=5.56g,所以样品中FeSO47H2O的质量分数为![]() × 100% = 93%,故答案为:酸式;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;93%。
× 100% = 93%,故答案为:酸式;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;93%。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某溶液中滴入BACl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A.一定有SO42- B.可能有SO42- 或Ag+ C.一定无Ag+ D.还可能有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。
H++A2-。
⑴NaHA溶液__________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定正确的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)= _________mol/L
II.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中不存在碳碳单、双键的交替结构,下列可以作为证据的事实是( )
①苯不能使高锰酸钾酸性溶液褪色
②苯不能使溴水因发生化学反应而褪色
③苯在加热和有催化剂存在的条件下能还原成环己烷
④苯中碳碳键的键长完全相等
⑤邻二氯苯只有一种
⑥间二氯苯只有一种
A. ①② B. ①⑤
C. ③④⑤⑥ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料.以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N.(部分产物及反应条件已略去)
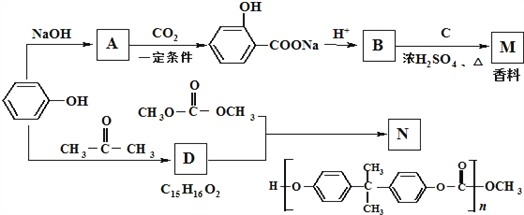
(1)B的官能团的名称是_______ .
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种,则C的结构简式为 ________.
(3)B与C反应的反应类型是_________________.由D生成N的反应类型是_________.
(4)由苯酚生成D的化学方程式是_________.
(5)F是分子量比B大14的同系物,则F的分子式是__________________ .F有多种同分异构体,符合下列条件的F的同分异构体有_______ 种
①属于芳香族化合物;
②遇FeCl3溶液显紫色,且能发生水解反应;
③苯环上有两个取代基,且苯环上的一溴代物只有两种。
(6)已知: ,写出以苯酚、乙醇和CH2ClCOOH为原料制备
,写出以苯酚、乙醇和CH2ClCOOH为原料制备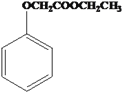 的合成路线流程图(无机试剂任用)__________________。
的合成路线流程图(无机试剂任用)__________________。
合成路线流程图示例如下:H2C═CH2![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_______________,所得溶液中c(H+)-c(OH-)=_______________(填写表达式)
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
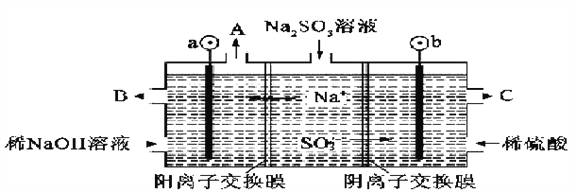
①图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②![]() 放电的电极反应式为_______________。
放电的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中正确的是
A.合金不具有金属光泽 B.金属和非金属之间不可能形成合金
C.生铁和钢都是铁的合金 D.钛合金比铁合金使用更广泛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧化铁砷合物)高温超导”材料研究上取得了重要成果,给研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)Fe在周期表的位置为
(2)氟、氧、砷三种元素中电负性最小的是__________(用元素符号填空)。
(3)氧的最简单氢化物键角为 ,砷的最简单氢化物分子空间构型为 。
(4)FeCl3晶体易溶于水,乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因: 。
(5)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图。

①已知CN-与N2结构相似,1molCN-中π键数目为 。
②上述沉淀溶解过程的化学式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com