
【题目】某炔烃与氢气加成得到2,3﹣二甲基戊烷,该炔烃可能有的结构简式有( )
A.1种
B.2种
C.3种
D.4种
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如图所示.
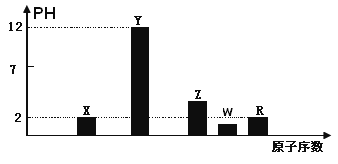
(1)元素R在周期表中的位置是
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(3)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
Ⅱ.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则反应I的化学反应方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,需要空气量的比较中正确是( )
A.烷烃最多
B.烯烃最多
C.炔烃最多
D.三者一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W,A是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,A、C、D的原子序数及0.1mol/L X、Z、W溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
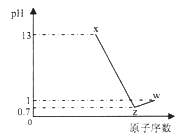
A. A的离子半径小于B的离子半径
B. W、X两物质含有的化学键类型相同
C. D氢化物稳定性小于C氢化物稳定性
D. B的简单离子会影响水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写):________________。
(2)下列操作中可能使所测NaOH的质量分数偏低的是__________。
a.滴定操作中,锥形瓶残留少量蒸馏水
b.B步操作中,装入烧碱溶液之前未用待测液润洗
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
(3)该烧碱样品纯度的计算式为______________________。
II.以下是FeSO4·7H2O的实验窒制备流理图。
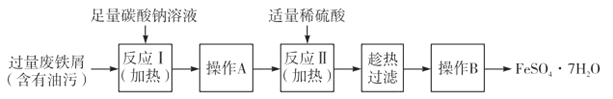
根据题意完成下列填空:
(1)反应1需要加热数分钟,其原因是 ;操作A为 。
(2)测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。KMnO4溶液应盛装在 滴定管中,发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2↑+H2O
CH2===CH2↑+H2O
CH2===CH2+Br2→BrCH2CH2Br
可能存在的副反应有乙醇在浓硫酸存在下140℃时脱水生成乙醚。
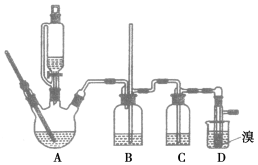
用少量的溴和足量的乙醇反应制备1,2二溴乙烷的装置如图所示:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是________(填序号,下同)。
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)在装置C中应加入___________,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是____________________。
(4)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在________(填“上”或“下”)层。
(5)若产物中有少量未反应的Br2,最好用________洗涤除去。
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为 ,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲-辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是
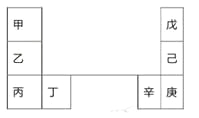
A. 金属性:甲>乙>丁
B. 辛是金属元素,元素符号为Ge
C. 丙和庚的原子核外电子数相差13
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com