
【题目】I. CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
II. T1温度下,体积为2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) ![]() 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)当反应达到平衡后,其他条件不变,分离出部分M,则新平衡时,正反应速率相对于原平衡____________(填“增大”、“减小”、或“不变”)。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些____。

a.Y的逆反应速率
b.M的体积分数
c.混合气体的密度
d.X的转化率
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.重新达平衡后,用X表示的υ(正)比原平衡大
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度____________1.5mol/L(填“大于”、“小于”或“等于”)。
【答案】![]() 吸热 减小 b d AC 小于
吸热 减小 b d AC 小于
【解析】
(1)①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1=
FeO(s)+CO(g)的平衡常数为K1=![]() ;
;
化学反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2=
FeO(s)+H2(g)的平衡常数为K2=![]() ;
;
反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=![]() =
=![]() ;
;
973K时K=![]() =
=![]() =0.68,1173K时K=
=0.68,1173K时K=![]() =
=![]() =1.43,故升高温度K值增大,则升高温度平衡正向移动,则正反应为吸热反应;
=1.43,故升高温度K值增大,则升高温度平衡正向移动,则正反应为吸热反应;
(2)当反应达到平衡后,其他条件不变,分离出部分M,即减小生成物浓度,平衡正向移动,则新平衡时,反应物浓度减小,正反应速率相对于原平衡减小;
(3)a.升高温度反应速率增大,所以不能表示Y的逆反应速率,选项a错误;
b.正反应放热,升高温度平衡向逆反应方向进行,M的体积分数减小,选项b正确;
c.正反应放热,升高温度平衡向逆反应方向进行,气体的质量增加,体积不变,混合气体的密度增大,选项c错误;
d.正反应放热,升高温度平衡向逆反应方向进行,X的转化率减小,选项d正确;
答案选b d;
(4)平衡时X是2mol,消耗X是2mol,同时消耗Y是1mol,则剩余Y是1mol,生成M是3mol,反应前后体积不变,可以用物质的量表示浓度计算平衡常数,则该反应的平衡常数K=![]() =6.75;
=6.75;
反应达到平衡后,若再加入3.00molM,3.00molN,则瞬间M变为6mol,则
2X(g)+Y(g) ![]() 3M(g)+N(s)
3M(g)+N(s)
起始量(mol) 2 1 6
转化量(mol)2x x 3x
平衡量(mol)2+2x 1+x 6-3x
则根据平衡常数可知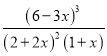 =6.75
=6.75
解得x=0.5
A.重新达平衡后,X的浓度增大,用X表示的υ(正)比原平衡大,选项A正确;
B.重新达平衡后,M的体积分数=![]() =50%,选项B错误;
=50%,选项B错误;
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍,C正确;
D.重新达平衡后,Y的平均反应速率与原平衡大,D错误;
答案选AC;
(5)由于反应放热,容器内温度升高,化学平衡逆移,c(M)减小,即达平衡后M的物质的量浓度小于1.5mol/L。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W__________、X__________、Y__________、Z__________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是____________(写化学式),还原剂是____________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________。
②化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:

(1)基态O原子的价电子排布图为___。
(2)组成青蒿素的三种元素中电负性最大的是__(填元素符号,下同),第一电离能最大的是__。
(3)基态N原子的未成对电子数为___。
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
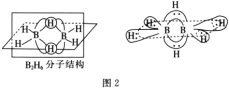
BH4-的空间构型为__;B2H6分子的结构如图2,B2H6中B的杂化方式为__。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是___。
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是__;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为__(已知![]() ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A.分子式为C9H18O2的酯,在酸性条件下加热可水解产生相对分子质量相同的两种有机物,则符合此条件的C9H18O2的结构有18种
B.甲苯和Cl2在光照下的反应与乙醇和乙酸在浓硫酸作用下的反应属于同一类型的反应
C.lmol![]() 与NaOH溶液反应,最多可消耗3molNaOH
与NaOH溶液反应,最多可消耗3molNaOH
D.淀粉、油脂和蛋白质都能在NaOH作用下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol硝基(-NO2)与46gNO2所含的电子数均为23NA
B.1mol环己烷中含有共价键数为12NA
C.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,转移的电子数为NA
D.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。

称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是___;锥形瓶中溶液冷却至室温后再加入氨水的原因__。
(2)C瓶中KMnO4溶液的作用是__。
(3)若要确保获得浅绿色悬浊液,下列符合实验要求的是__(填字母)。
a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是__。
a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)实验探究:影响溶液中Fe2+稳定性的因素。
配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2ml上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:___。
(6)称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___(用含c、V、a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹(结构如图所示)可用于治疗新冠肺炎,2020年3月4日印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确规定了其用量。下列关于磷酸氯喹的说法错误的是( )

A.化学式为![]()
B.含有2个![]() 杂化的氮原子和1个
杂化的氮原子和1个![]() 杂化的氮原子
杂化的氮原子
C.所含官能团之一为氯原子(碳氯键)
D.可以发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
③CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=___(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
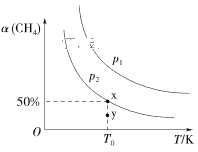
①若容器中的压强为p2,y点:v正____(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=___。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
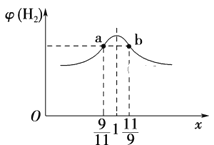
则CH4的转化率:a点____(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点_____b点,氢气的产率:a点____b点。
Ⅲ.(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com