
【题目】如图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:
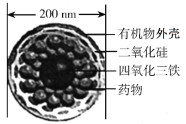
(1)“纳米药物分子车”分散于水中所得的分散系__(填“属于”或“不属于”)胶体。
(2) “纳米药物分子车”的外壳属于有机物。酒精、蔗糖、冰醋酸这三种有机物中,属于电解质的是__。
(3)从元素组成的角度分析,SiO2和Fe3O4可归为同一类物质,其类别属于化合物中的__。
(4)纳米级的Fe3O4是一种非常重要的磁性材料。
①Fe3O4溶于稀盐酸生成FeCl3、__和H2O。
②铁在氧气中燃烧生成Fe3O4,反应中每生成1molFe3O4转移__mol电子。
【答案】不属于 冰醋酸 氧化物 FeCl2 8
【解析】
(1)从胶体的定义出发进行判断。
(2) 从定义入手,判断物质是否属于电解质。
(3)从元素组成给化合物分类。
(4) ①Fe3O4溶于稀盐酸,借助复分解反应的模式推出生成物。
②从价态变化入手,分析电子转移的数目。
(1)由图可知“纳米药物分子车”的直径为200nm,而胶体中分散质的直径为1~100nm,因此“纳米药物分子车”分散于水中所得的分散系不属于胶体。答案为:不属于;
(2)电解质是溶于水或在熔融状态下能够导电(自身电离出自由移动离子)的化合物。其中酒精、蔗糖溶于水仍然以分子的形式存在,而冰醋酸(纯净物,即无水乙酸)溶于水可电离出氢离子与醋酸根离子,则属于电解质的是冰醋酸。答案为:冰醋酸;
(3)从元素组成的角度分析,SiO2和Fe3O4均只含两种元素其中一种元素是氧元素的化合物,那么类别就为氧化物。答案为:氧化物;
(4)①Fe3O4+8HCl=FeCl2+2FeCl3+4H2O。答案为:FeCl2;
②根据3Fe+2O2![]() Fe3O4,首先标出变价元素,可从氧元素入手,反应前0价,反应后-2价,则每2摩尔氧气参与反应转移了8mol电子,那么反应中每生成1molFe3O4转移8mol电子。答案为:8。
Fe3O4,首先标出变价元素,可从氧元素入手,反应前0价,反应后-2价,则每2摩尔氧气参与反应转移了8mol电子,那么反应中每生成1molFe3O4转移8mol电子。答案为:8。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.惰性电极电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.钢铁吸氧腐蚀中的正极反应:4OH-- 4e-=2H2O+O2 ↑
C.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ~Ⅳ所示,下列有关说法正确的是( )
A.实验Ⅰ可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体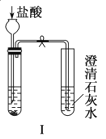
B.实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠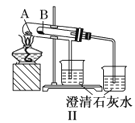
C.与实验Ⅲ相比,实验Ⅱ的优点是可以用一套装置同时进行两个对比实验,而Ⅲ不行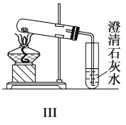
D.实验Ⅳ分别测定等浓度碳酸钠和碳酸氢钠溶液的pH,碳酸氢钠溶液pH大于碳酸钠溶液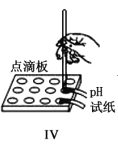
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
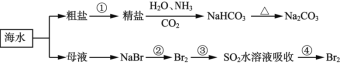
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
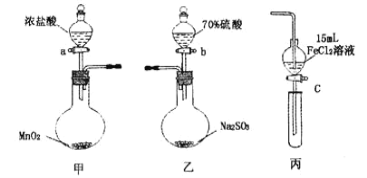
实验步骤:
(1)在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
(2)当丙装置中FeC12溶液变黄时,停止加热。
(3)打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
(4)在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
(5)更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)乙中发生反应的化学方程式为_________。
(2)实验中,证明氧化性Fe3+>SO2的离子方程式为_________。
(3)将甲装置与丙装置连接的目的是_______。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如图:

上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是______(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂____、___和一种溶剂_____。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液________则结论正确。
④停止通入Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四幅图示所表示的信息与对应的叙述相符的是( )

A. 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol—1
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3
D. 图4表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com