
| A. | 硫酸比盐酸稳定 | B. | 氯化氢比硫化氢稳定 | ||
| C. | 盐酸酸性比氢硫酸强 | D. | 亚硫酸酸性比高氯酸弱 |
分析 元素得电子能力越强,其单质的氧化性越强、其单质与氢气化合越容易、其单质的稳定性越强、其最高价氧化物的水化物酸性越强,据此分析解答.
解答 解:A.硫酸比盐酸稳定,但不能说明非金属性S<Cl,所以不能说明硫原子得电子能力小于Cl,故A错误;
B.元素得电子能力越强,其氢化物越稳定,氯化氢比硫化氢稳定,说明得电子能力Cl>S,故B正确;
C.盐酸酸性比氢硫酸强,说明HCl易电离、氢硫酸难电离,但不能说明硫原子得电子能力小于Cl,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以可以根据其最高价氧化物的水化物酸性强弱判断非金属得电子能力强弱,亚硫酸不是S元素的最高价含氧酸,所以不能根据亚硫酸酸性小于高氯酸而判断元素得电子能力强弱,故D错误;
故选B.
点评 本题以元素得电子能力为载体考查元素周期律,为高频考点,明确非金属性强弱判断方法是解本题关键,侧重考查学生知识运用能力,易错选项是D,注意:元素得电子能力强弱与得电子难易程度有关,与得电子多少无关,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
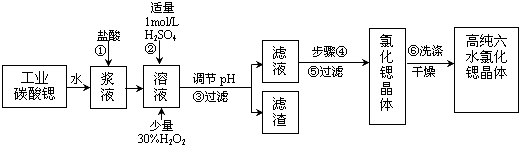
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
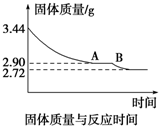 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法不正确的是( )| A. | Na2O2中阴阳离子数目之比为1:2 | |
| B. | 反应①的离子方程式为:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 反应③最多能产生0.05 mol O2 | |
| D. | ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含CuSO4的废水直接排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3OOCCH3甲酸乙酯 | ||
| C. | 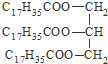 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 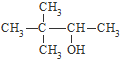 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NO3-、SO42-、Na+ | B. | Ca2+、H+、Cl-、HCO3- | ||
| C. | NH4+、Al3+、NO3-、OH- | D. | Ba2+、ClO-、SO42-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com