
【题目】下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为放热反应
C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 molL-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

(1)图中A点表示沉淀的化学式是_____,其物质的量是_____。
(2)反应至A点时消耗NaOH溶液的体积为________。
(3)AlCl3溶液的浓度为________。
(4)假设溶液中有0. 39克Al(OH)3沉淀,则此时用去NaOH溶液体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是( )
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)(mol·L-1·min-1)表示,逆反应速率分别用v′(SO2)、v′(O2)、v′(SO3)(mol·L-1·min-1)表示,当反应达到化学平衡时,正确的关系是( )
①v(SO2)=v′(SO2) ②v(O2)=v′(SO2)=v(SO3)
③v(O2)=![]() v′(SO2) ④v′(SO2)=v′(O2)=v′(SO3)
v′(SO2) ④v′(SO2)=v′(O2)=v′(SO3)
A. ①②③④B. ①②③C. ②③④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D和E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图所示:

只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为N2H4,可作火箭燃料;甲、乙为非金属单质;X分子中含有10个电子,它们之间的转化关系如图所示:

回答下列问题:
(1)甲和乙生成标准状况下1.12 L Y,吸收9.025 kJ的热量,写出反应的热化学方程式:____。
(2)一定量E的单质与NaOH溶液恰好完全反应后,所得溶液的pH__7(填“大于”“等于”或“小于”),原因是________(用离子方程式表示)。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时,正极反应式为_____________,负极反应式为_________。
(4)将一定量的A2、B2混合气体放入1 L密闭容器中,在500 ℃、2×107Pa下反应达到平衡,测得平衡气体的总物质的量为0.5 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为____,该温度下该反应的平衡常数为_____。
(5)在密闭容器中充入一定量的A2、B2混合气体,改变外界条件,H2的转化率变化如图所示:则X可代表什么____?

A、温度的变化 B、压强的变化 C、n(B2)/n(A2)的变化 D、催化剂接触面积多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,根据元素a~j在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
(1)在a ~j中,化学性质最不活泼的元素是___________(填元素符号)。
(2)f、g、h的单质分别与水反应,最剧烈的是___________(填元素符号)。
(3)c、i的氢化物稳定性较强的是____________(填化学式)。
(4)c、f可形成既含离子键又含非极性键的化合物,该化合物的电子式为__________。
(5)d、f、g的离子半径最大的是_______________(填离子符号)。
(6)f的最高价氧化物的水化物与h的最高价氧化物的水化物反应的离子方程式为:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
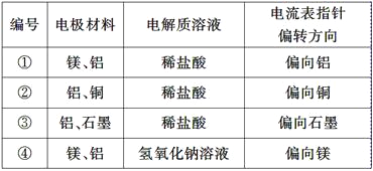
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度升高,M的转化率________(填“增大”、“减小”或“不变”)。
③若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
④若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_____v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
②对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
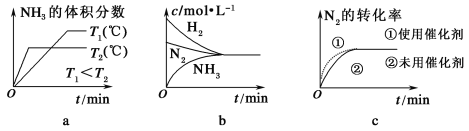
③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应A(s)+2B(g)![]() C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述中错误的是
A. 在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol/(Lmin)
B. 5 min时,容器内D的浓度为0.2 mol/L
C. 该可逆反应随着反应的进行,容器内压强逐渐增大
D. 5 min时,容器内气体总的物质的量为3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com