
【题目】(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度升高,M的转化率________(填“增大”、“减小”或“不变”)。
③若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
④若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_____v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
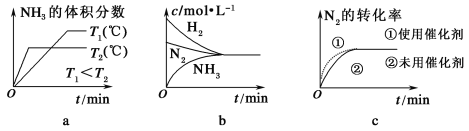
②对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
【答案】25%增大6<小a、c<<<
【解析】
(1)△c(M)=60%×1molL-1=0.6molL-1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6molL-1,故此时N的转化率0.6/2.4×100%=25%;综上所述,本题答案:25%。
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;综上所述,本题答案是:增大。
(3))△c(M)=60%×1molL-1=0.6molL-1,则:
M(g)+N(g)P(g)+Q(g);
初始(mol/L): 1 2.4 0 0
转化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故该温度下平衡常数k=0.6×0.6/0.4×1.8=0.5;
反应温度不变,反应物的起始浓度分别为c(M)=4molL-1,c(N)=amolL-1;达到平衡后,c(P)=2molL-1,则:
M(g)+N(g)P(g)+Q(g);
初始(mol/L):4 a 0 0
转化(mol/L):2 2 2 2
平衡(mol/L):2 a-2 2 2
所以2×2/2×(a-2)=0.5,解得a=6,综上所述,本题答案:6。
④该反应的浓度商为QC=c(P)c(Q)/c(M)c(N)= 2×2/2×2=1,该温度下的平衡常数为0.5,QC>k,平衡左移,v(正) <v(逆);综上所述,本题答案:<。
(2)①该反应为放热反应,温度越高,平衡左移,平衡常数的值越小;综上所述,本题答案是:小。
②a.图像中曲线先出现拐点的先达到平衡,则T2温度高;升高温度,平衡逆向移动,则氨气的体积分数减小,但反应到达平衡的时间缩短,与图像一致,故正确;
b.反应到达平衡时,各物质浓度变化量之比等于其计量数之比,氢气与氨气浓度变化量之比为3:2,图像表示错误;故错误;
c.使用催化剂加快反应速率,缩短反应时间,但不影响平衡移动,氮气的转化率不变,符合题意,与图像一致,故正确;
综上所述,本题答案:a、c。
③恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;而恒压密闭容器B,均充入1 mol N2和3 mol H2,反应发生后总物质的量减少,由Pv=nRT可以知道,相对于A来说,相当于给B加压,则平衡正向移动,氨气的体积分数变大,所以a<b;生成的氨气多,反应向右进行的程度大,所以B中放出的热量多,则Q1<Q2;热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4;综上所述,本题答案是: < , < , <。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用足量的CO还原8 g铁的氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为15g,则此铁氧化物的化学式是
A. Fe2O3 B. FeO C. Fe3O4 D. Fe3O4和FeO的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为放热反应
C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
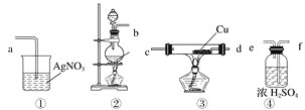
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应CuSO4+FeS2+H2O→Cu2S+FeSO4+H2S04判断1molCuS04能氧化硫的物质的量是
A. 3/11 mol B. 1/7 mol C. 5/7 mol D. 4/7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图。已知锌的熔点420 ℃、沸点906 ℃。则下列说法不正确的是

A. 升炼倭铅过程包含分解反应和氧化还原反应
B. 冶炼时锌变为蒸气在兜室冷凝为固体
C. “泥封”的目的是为了防止得到的锌被氧化
D. “锌火”是锌蒸气和一氧化碳在空气的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O![]() VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是
VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是

A. 全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 全钒液流电池充电时,V3+被氧化为VO2+
D. 电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称_______、_______、_______。
(2)C在元素周期表中的位置是___________________。
(3)B的原子结构示意图为______。C的氢化物与B的氢化物的稳定性强弱顺序为(填化学式)___________。
(4)比较A、C的原子半径A____C。写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com