
����Ŀ��A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ��,ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȡ�B��D��E����Ԫ�������ڱ������λ����ͼ��ʾ��

ֻ��EԪ�صĵ�������ˮ��Ӧ���������ᡣ�ס��ҡ�M��W��X��Y��Z�������ʾ���A��B��D����Ԫ���е�һ�ֻ������,����ֻ��M����ͬʱ��������Ԫ��;WΪN2H4,�������ȼ��;�ס���Ϊ�ǽ�������;X�����к���10������,����֮���ת����ϵ��ͼ��ʾ��

�ش���������:
(1)�������ɱ�״����1.12 L Y,����9.025 kJ������,д����Ӧ���Ȼ�ѧ����ʽ:____��
(2)һ����E�ĵ�����NaOH��Һǡ����ȫ��Ӧ��,������Һ��pH__7(����ڡ������ڡ���С�ڡ�),ԭ����________(�����ӷ���ʽ��ʾ)��
(3)W-����ȼ�ϵ����һ�ּ���ȼ�ϵ��,�������Һ��20%~30%��KOH��Һ��W-����ȼ�ϵ�طŵ�ʱ,������ӦʽΪ_____________,������ӦʽΪ_________��
(4)��һ������A2��B2����������1 L�ܱ�������,��500 �桢2��107Pa�·�Ӧ�ﵽƽ��,���ƽ������������ʵ���Ϊ0.5 mol,����A2Ϊ0.3 mol,B2Ϊ0.1 mol�����������A2��ƽ��ת����Ϊ____,���¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ_____��
(5)���ܱ������г���һ������A2��B2������壬�ı����������H2��ת���ʱ仯��ͼ��ʾ����X�ɴ���ʲô____��

A���¶ȵı仯 B��ѹǿ�ı仯 C��n(B2)/n(A2)�ı仯 D�������Ӵ��������
���𰸡�N2(g)+O2(g)=2NO(g)����H= -361 kJ��mol-1 ���� ClO-+H2O![]() HClO+OH- O2+2H2O+4e-=4OH- N2H4+4OH--4e-=N2+4H2O 33.3% 100/27 (mol��L-1) BC
HClO+OH- O2+2H2O+4e-=4OH- N2H4+4OH--4e-=N2+4H2O 33.3% 100/27 (mol��L-1) BC
��������
����Ϊ������ƶϡ�A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȣ���֪Ԫ��A��H����Ԫ�������ڱ���λ�ã���֪B��Dλ�ڵڶ����ڣ�Eλ�ڵ������ڣ���EԪ�صĵ�������ˮ��Ӧ���������ᣬ��EΪCl������֪BΪNԪ�ء�DΪOԪ�أ��ס��ҡ�M��W��X��Y��Z�������ʾ���H��N��O����Ԫ���е�һ�ֻ�����ɣ�����WΪN2H4���ס���Ϊ�ǽ������ʣ�X���Ӻ���10�����ӣ����ת����ϵ��֪������O2������N2��X��H2O�����ο��Ƶ���Y��NO��Z��NO2��M��HNO3���ݴ˽��
A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȣ���֪Ԫ��A��H����Ԫ�������ڱ���λ�ã���֪B��Dλ�ڵڶ����ڣ�Eλ�ڵ������ڣ���EԪ�صĵ�������ˮ��Ӧ���������ᣬ��EΪCl������֪BΪNԪ�ء�DΪOԪ�أ��ס��ҡ�M��W��X��Y��Z�������ʾ���H��N��O����Ԫ���е�һ�ֻ�����ɣ�����WΪN2H4���ס���Ϊ�ǽ������ʣ�X���Ӻ���10�����ӣ����ת����ϵ��֪������O2������N2��X��H2O�����ο��Ƶ���Y��NO��Z��NO2��M��HNO3��
��1�������͵������ɱ�״����1.12LNO����9.025kJ��������������0.05molNO����9.025 kJ��������������2molNO���յ�����Ϊ9.025kJ��4=361kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽΪN2(g)+O2(g)=2NO(g)��H=+361kJ/mol����С���Ϊ��N2(g)+O2(g)=2NO(g)��H=+361kJ/mol��
��2��һ����������NaOH��Һǡ����ȫ��Ӧ��õ���Ũ�ȵ�NaCl��NaClO��Һ����Һ�д����������ˮ�⣬ˮ������ӷ���ʽΪClO+H2OHClO+OH���ƻ�ˮ�ĵ���ƽ�⣬��Һ�ʼ��ԣ�������Һ��pH����7����С���Ϊ��������ClO+H2OHClO+OH��
��3������������ԭ��Ӧ�������������õ��ӣ���������������OH������ӦʽΪ��O2+2H2O+4e=4OH����������������Ӧ��ʧȥ���ӣ��������������ɵ�����ˮ��������ӦʽΪ��N2H4+4OH4e�TN2+4H2O����С���Ϊ��O2+2H2O+4e=4OH��N2H4+4OH4e�TN2+4H2O��
��4�����ƽ������������ʵ���Ϊ0.50mol������A2Ϊ0.3mol��B2Ϊ0.1mol����
3H2(g)+N2(g)2NH3(g)
��ʼ(mol) 0.45 0.15 0
ת��(mol) 0.15 0.05 0.1
ƽ��(mol) 0.3 0.1 0.50.30.1=0.1
���������H2��ƽ��ת����Ϊ0.15mol/0.45mol��100%=33.3%��
�������Ϊ1L�������ʵ�������Ũ�ȼ���ƽ�ⳣ������K=0.12/(0.33��0.1)=100/27
��С���Ϊ��33.3%��100/27��
��5����֪��Ӧ3H2(g)+N2(g)2NH3(g)��H<0��ͼ�б�ʾH2��ת���������X�������������
A.�����¶�ƽ�������ƶ���H2��ת���ʽ��ͣ���A����
B.����ѹǿƽ�������ƶ���H2��ת�������ߣ���B��ȷ��
C.n(B2)/n(A2)����˵��������N2�������СH2������H2��ת���ʾ�����C��ȷ��
D.�������ı�ƽ����ƶ�����Ӱ��H2��ת���ʣ���D����С���Ϊ��BC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ѧʽ��ȷ��ʾ���ʷ�����ɵ���( )
A.�Ȼ��ƾ���(NaCl)B.�ɱ�(CO2)
C.ˮ��(SiO2)D.���(Ar)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D���ɳ����Ķ����ڷǽ���Ԫ���γɵĵ��ʣ�������A�ǵ���ɫ��ĩ��B��D�����壬F��G��H����ɫ��Ӧ��Ϊ��ɫ��ˮ��Һ���Լ��ԣ�E��Ư���ԡ�����֮���ת����ϵ��ͼ��ʾ�����ֲ��P��Ӧ��������ȥ�����ش��������⣺
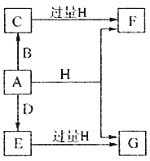
��1��A����Ԫ�������ڱ��е�λ��Ϊ______________��C�ĵ���ʽΪ_______________��
��2��A��H�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ__________________��
��3����A���ڷ��ڵ�G��Һ�п����Ƶû�����I��I��������Һ�в��ȶ��������ɵ����ʵ�����A��E��I����������������A��E�����ӷ���ʽΪ____________________��I����ǿ��ԭ�����ڷ�֯����ֽ��ҵ����Ϊ���ȼ�����I��Һ��ͨ�������ɷ�����Ӧ���μӷ�Ӧ��I�����������ʵ�����Ϊ1:4���÷�Ӧ�����ӷ���ʽΪ__________________��
��4������0.4molF��0.1molG�Ļ����Һ�м���������ᣬ��ȫ��Ӧ���ռ���aL����C����״������ȡ��Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g����a=____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A. �ô����ȥˮ����CaCO3+2H+=Ca2++H2O+CO2��
B. ��ͭΪ�缫��ⱥ��ʳ��ˮ��2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
C. FeBr2��Һ��ͨ�����Cl2��2Fe2++Cl2=2Fe3++2Cl-
D. ��FeCl3��Һ��ʴӡˢ��·����ͭ�䣺2Fe3++Cu=2Fe2++Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�ò��������Ӧʵ����ǣ� ��

A. ��װ�����������������Ļ�ѧ��Ӧ����
B. ��װ�����Ƚ�NaHCO3��Na2CO3�����ȶ���
C. װ�����з�Һ©���ڵ�Һ���˳������������ƿ
D. װ������ʵ����ȡCO2ʵ���е������ؼ�ֹ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ļ���ԭ�ϣ�����ϩΪԭ���ڲ�ͬ�����¿ɺϳ��������ʣ���������δ�������

������Ҫ��д����
��1������ϩ�Ľṹ��ʽ��_____________����ȩ�Ľṹ��ʽ��_____________��
��2����Ӧ�ٵĻ�ѧ����ʽ��________________________________����Ӧ������___________��
��3����Ӧ�۵Ļ�ѧ����ʽ��________________________________����Ӧ������___________��
��4����Ӧ�ݵĻ�ѧ����ʽ��________________________________����Ӧ������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.����ȼ�ϵ�طŵ�ʱ��ѧ��ȫ��ת��Ϊ����
B.��Ӧ4Fe(s)+3O2(g)=2Fe2O3(s)�����¿��Է����У��÷�ӦΪ���ȷ�Ӧ
C.��ø������ˮ�ⷴӦ�У��¶�Խ�ߵ���ˮ������Խ��
D.��������������ʴʱ������ʴ�����ʺ�����Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�ӦCuSO4+FeS2+H2O��Cu2S+FeSO4+H2S04�ж�1molCuS04������������ʵ�����
A. 3/11 mol B. 1/7 mol C. 5/7 mol D. 4/7 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3��g����5O2��g��![]() 4NO��g����6H2O��g����5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ������vΪ
4NO��g����6H2O��g����5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ������vΪ
A. v��O2����0.01mol/��L��s�� B. v��NO����0.08mol/��L��s��
C. v��H2O����0.003mol/��L��s�� D. v��NH3����0.001mol/��L��s��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com