
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

按下列要求写出:
(1)聚乙烯的结构简式是_____________,乙醛的结构简式是_____________;
(2)反应①的化学方程式是________________________________,反应类型是___________;
(3)反应③的化学方程式是________________________________,反应类型是___________;
(4)反应⑤的化学方程式是________________________________,反应类型是___________。
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) = CO(g)+3H2(g)ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) = 2CO(g)+2H2(g)ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________。
(2)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________________。
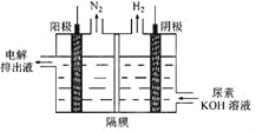
(3) Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )

A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D和E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图所示:

只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为N2H4,可作火箭燃料;甲、乙为非金属单质;X分子中含有10个电子,它们之间的转化关系如图所示:

回答下列问题:
(1)甲和乙生成标准状况下1.12 L Y,吸收9.025 kJ的热量,写出反应的热化学方程式:____。
(2)一定量E的单质与NaOH溶液恰好完全反应后,所得溶液的pH__7(填“大于”“等于”或“小于”),原因是________(用离子方程式表示)。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时,正极反应式为_____________,负极反应式为_________。
(4)将一定量的A2、B2混合气体放入1 L密闭容器中,在500 ℃、2×107Pa下反应达到平衡,测得平衡气体的总物质的量为0.5 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为____,该温度下该反应的平衡常数为_____。
(5)在密闭容器中充入一定量的A2、B2混合气体,改变外界条件,H2的转化率变化如图所示:则X可代表什么____?

A、温度的变化 B、压强的变化 C、n(B2)/n(A2)的变化 D、催化剂接触面积多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究钠与二氧化碳的反应,利用如图装置进行实验。

已知PdCl2能被一氧化碳还原得到黑色的Pd。请回答下列问题:
(1)请将上图各装置连接完整:c接f,______接______,______接______,______接______。
(2)若用稀盐酸与碳酸钙反应制备二氧化碳,在加稀盐酸时,发现碳酸钙与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______(填字母)。
A.硝酸钠溶液 B.四氯化碳 C.苯 D.稀硝酸
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让二氧化碳充满整个装置,当观察到________________时,再点燃酒精灯。此步操作的目的是________________________________。
(4)反应过程中二氧化碳足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与二氧化碳反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体: ___________________________。
Ⅱ.装置①中钠的质量为0.46 g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224 mL(标准状况)二氧化碳气体,且溶液中还有固体残留:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
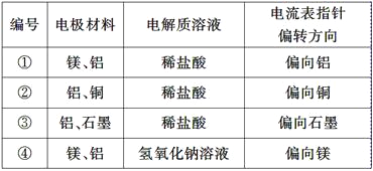
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是

A. 电流由a极流向b极
B. 溶液中的OH﹣向b极移动
C. a极的电极反应式为:2NH3﹣6e﹣═N2+6H+
D. b极的电极反应式为:O2+4e﹣+2H2O═4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com