
【题目】由乙烯和其他无机原料可合成环状化合物,其合成过程如下图所示(水及其他无机产物均已省略):
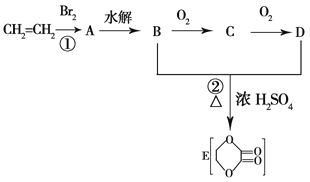
请分析后回答下列问题:
(1)反应的类型分别是①________,②________。
(2)D物质中的官能团为________。
(3)C物质的结构简式为________,物质X与A互为同分异构体,则X的结构简式为________,X的名称为________。
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_______________。
【答案】加成反应 酯化反应 -COOH(或羧基) OHC-CHO CH3-CHBr2 1,1-二溴乙烷 nCH2OHCH2OH+nCCOC-COOH![]()
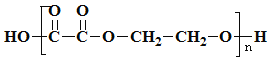 +(2n-1)H2O
+(2n-1)H2O
【解析】
CH2=CH2和溴发生加成反应,生成A为CH2BrCH2Br,水解生成B为CH2OHCH2OH,氧化产物C为OHC-CHO,进而被氧化为D为HOOC-COOH,B为CH2OHCH2OH与D为HOOC-COOH发生酯化反应生成环酯E ,结合有机物的结构和性质可解答该题。
,结合有机物的结构和性质可解答该题。
根据上述分析可知:A为CH2BrCH2Br,B为CH2OHCH2OH,C为OHC-CHO,D为HOOC-COOH,E为 。
。
(1)由以上分析可知,反应①为CH2=CH2和溴发生加成反应产生CH2BrCH2Br;反应②为CH2OHCH2OH与HOOC-COOH发生酯化反应,产生 ,故反应①类型为加成反应,反应②类型为酯化反应;
,故反应①类型为加成反应,反应②类型为酯化反应;
(2)由以上分析可知,D为HOOC-COOH,其中的官能团名称为羧基;
(3)C为OHC-CHO,A为CH2BrCH2Br,物质X与A互为同分异构体,则X结构简式为CH3-CHBr2,该物质名称为1,1-二溴乙烷;
(4)B为CH2OHCH2OH,D为HOOC-COOH,二者出能反应产生环状化合物E外,还可以反应产生一种高分子化合物,则B+D→高分子化合物反应的方程式为nCH2OHCH2OH+nCCOC-COOH![]()
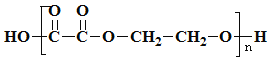 +(2n-1)H2O。
+(2n-1)H2O。


科目:高中化学 来源: 题型:
【题目】某科研小组以难溶性钾长石(K2OAl2O36SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
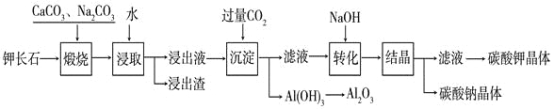
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是:______________________________。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O![]() Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是______________________________(用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______________、_______________和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是___________________。长时间电解后,需要更换新的石墨电极的是________极(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
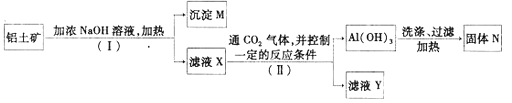
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如下:
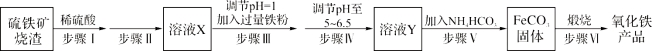
试回答下列问题:
(1)步骤Ⅰ所得溶液中铁元素的化合价是 。
(2)实验室中实现步骤Ⅱ中分离操作需要的仪器有 、铁架台、玻璃棒、烧杯。
(3)步骤Ⅲ中发生的离子方程式 ,向反应后的溶液中加入试剂 ,当观察到 说明步骤Ⅲ已经进行完全。
(4)步骤Ⅳ中不能选用试剂 调节溶液的pH(填字母编号)。
a.FeO固体 b.氢氧化钠溶液 c.Fe2O3固体 d.氨水
(5)室温下FeCO3达到溶解平衡时溶液pH=8.5,c(Fe2+)=1.2×10-6 mol·L-1。则FeCO3固体产物中 (选填“有”或“无”)Fe(OH)2。(已知:Ksp[Fe(OH)2]=4.8×10-16)
(6)步骤Ⅵ中发生反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)能与KI溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点,反应为:2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是________,每消耗1molO3,转移___mole-。
(2)计算大气中臭氧的体积分数___。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组进行CH4的性质探究实验。
(1)通入高锰酸钾酸性溶液,现象是_____。
(2)在无色玻璃集气瓶中与Cl2混合后光照,现象是____。
(3)为了验证CH4是否具有还原性,某小组设计了如下实验:

实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是_______。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:3A(g)+B(g)![]() 2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为________,此温度下的平衡常数K=________。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向________(填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比![]() 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率________;若将C分离出来,化学平衡常数________。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下,将分别盛满如下体积比的混合气体的四支相同的试管倒立于水槽中,最后试管内液面上升的高度最高的是
A.V(NO2)∶V(O2)=2∶1B.V(NO)∶V(O2)=2∶1
C.V(NH3)∶V(O2)=2∶1D.V(NO2)∶V(NO)∶V(O2)=1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com