
【题目】臭氧(O3)能与KI溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点,反应为:2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是________,每消耗1molO3,转移___mole-。
(2)计算大气中臭氧的体积分数___。(写出计算过程)
【答案】2KI+O3+H2O=2KOH+O2+I2 2 2.00×10-5%
【解析】
(1)臭氧(O3)通入KI溶液中,生成氧气,在反应后的溶液中滴入酚酞变为红色,则另一产物为KOH,从而写出反应的方程式;每消耗1molO3,只有1molO原子得电子,由0价降低为-2价,从而得出转移电子的物质的量。
(2)利用两个化学方程式,可以建立以下关系式:O3——I2——2Na2S2O3,代入数据,便可求出结果。
(1)臭氧(O3)通入KI溶液中,生成氧气、KOH和H2O,由此得出反应的方程式2KI+O3+H2O=2KOH+O2+I2;每消耗1molO3,只有1molO原子得电子,由0价降低为-2价,从而得出转移电子的物质的量为2mol。答案为:2KI+O3+H2O=2KOH+O2+I2;2;
(2)利用两个化学方程式,可以建立以下关系式:O3——I2——2Na2S2O3
设O3的物质的量为x,则:
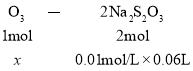
x=3×10-4mol,大气中臭氧的体积分数为![]() =2.00×10-5%。
=2.00×10-5%。
答案为:2.00×10-5%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】300℃时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)![]() 2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
(1)求该反应的平衡常数____。
(2)求平衡时A的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿![]() 主要成分为
主要成分为![]() 生产高锰酸钾产生的锰泥中,还含有
生产高锰酸钾产生的锰泥中,还含有![]() 的
的![]() 、
、![]() 的
的![]() 均为质量分数
均为质量分数![]() ,及少量Cu、Pb的化合物等,用锰泥可回收制取
,及少量Cu、Pb的化合物等,用锰泥可回收制取![]() ,过程如图:
,过程如图:
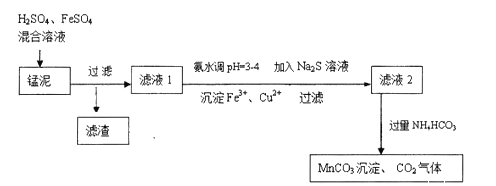
![]() 高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
![]() 除去滤液1中
除去滤液1中![]() 的离子方程式是 ______ .
的离子方程式是 ______ .
![]() 经实验证明:
经实验证明:![]() 稍过量时,起始
稍过量时,起始![]() 、
、![]() 混合溶液中
混合溶液中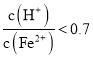 时,滤液1中能够检验出有
时,滤液1中能够检验出有![]() ;
;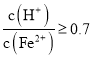 时,滤液1中不能检验出有
时,滤液1中不能检验出有![]() 根据上述信息回答①②③:
根据上述信息回答①②③:
①检验![]() 是否氧化完全的实验操作是 ______ .
是否氧化完全的实验操作是 ______ .
②生产时![]() 、
、![]() 混合溶液中
混合溶液中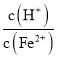 应控制在
应控制在![]() 之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
③若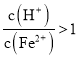 ,调节
,调节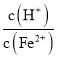 到
到![]() 的最理想试剂是 ______
的最理想试剂是 ______ ![]() 填序号
填序号![]()
![]() 溶液
溶液 ![]() 铁粉
铁粉 ![]()
![]() 写出滤液2中加入过量
写出滤液2中加入过量![]() 反应的离子方程式: ______ .
反应的离子方程式: ______ .
![]() 上述过程锰回收率可达
上述过程锰回收率可达![]() ,若处理1740kg的锰泥,可生产
,若处理1740kg的锰泥,可生产![]() ______ kg.
______ kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,可逆反应2X +Y(g)![]() Z(s)已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是( )
A.若X为非气态,则正反应为吸热反应
B.正反应为放热反应,X一定为气态
C.正反应为放热反应,X可能是气态、液态或固态
D.若加入少量的Z,该平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种有机物分别由碳、氢、氧元素中的两种或三种元素组成各取四种有机物0.1mol,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,D的水溶液显酸性。四种有机物转化关系如图:
![]()
回答下列问题:
(1)A、D分子中所含官能团的名称分别是______、______。
(2)a mol A、B的混合气体完全燃烧,消耗氧气的体积为______(标准状况)。
(3)B→C的化学方程式________,反应类型______。
(4)在实验室里可以用如图所示的装置制取乙酸乙酯。
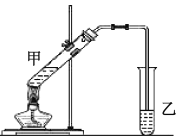
①写出用![]() 与乙酸发生酯化反应的化学方程式_________。
与乙酸发生酯化反应的化学方程式_________。
②反应开始前,试管乙中盛放的试剂为______,制乙酸乙酯时,试管甲中试剂加入顺序为______。
③合成乙酸乙酯的反应为放热反应,实验表明,反应温度应控制在85℃左右为宜。本实验温度不宜低于85℃左右的原因是________。
(5)对所得乙酸乙酯粗产品的提纯过程如下(已知:氯化钙与乙醇生成难溶物)。
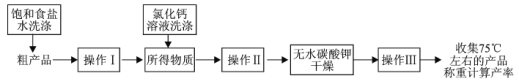
图中操作Ⅰ的名称为_______,操作Ⅱ的名称为_______,操作Ⅲ的名称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料可合成环状化合物,其合成过程如下图所示(水及其他无机产物均已省略):
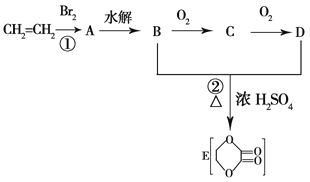
请分析后回答下列问题:
(1)反应的类型分别是①________,②________。
(2)D物质中的官能团为________。
(3)C物质的结构简式为________,物质X与A互为同分异构体,则X的结构简式为________,X的名称为________。
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了 17.6g。该有机物的化学式是
A. C2H4 B. C2H6O C. C2H6O2 D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了![]() n mol,C增加了
n mol,C增加了![]() n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=_____、b=______、c=_____、d=______。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为______。
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氢氧化钠溶液吸收二氧化硫,将所得的混合液进行电解循环再生,其中阴阳膜组合循环再生机理如图所示,下列有关说法不正确的是( )
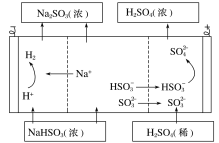
A.阳极区酸性增强
B.阴极的电极反应为2H++2e-===H2↑
C.该过程中的副产品主要为H2SO4
D.电解时两个电极都只能用惰性电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com