
| A.只有AgI沉淀生成 |
| B.AgCl和AgI沉淀等量生成 |
| C.AgCl和AgI沉淀都有,但以AgCl沉淀为主 |
| D.AgCl和AgI沉淀都有,但以AgI沉淀为主 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:计算题
 Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) 2Ag++
2Ag++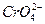 。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(
。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(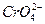 )=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
)=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答: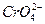 谁先沉淀?
谁先沉淀?查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸钡放入水中不导电,则硫酸钡是非电解质 |
| B.物质溶于水达到饱和时,溶解过程就停止了 |
| C.绝对不溶解的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为零 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 |
| B.图中a点对应的是饱和溶液 |
| C.向c点的溶液中加入0.1mol?L-1Hg(NO3)2,则c(S2-)减小 |
| D.升高温度可以实现c点到b点的转化 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.升高温度,AgCl的溶解度增大,Ksp不变 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.向AgCl饱和溶液中加入NaCl固体,AgCl的溶解度和Ksp都不变 |
| D.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com