
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、CO32-、SO42-、Cl-。现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量KOH溶液加热后,收集到气体0.08 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。
根据上述实验,以下推测正确的是
A.Na+一定存在
B.100 mL溶液中含0.01 mol CO32-
C.Cl-一定存在
D.Ba2+一定不存在,Mg2+可能存在
【答案】A
【解析】
根据题意,Ba2+和SO42﹣可发生离子反应生成BaSO4沉淀,因此两者不能大量共存,Ba2+和CO32﹣可发生离子反应生成BaCO3沉淀,因此两者也不能大量共存。
第一份加入AgNO3溶液有沉淀产生,可能发生Cl﹣+Ag+═AgCl↓、CO32﹣+2Ag+═Ag2CO3↓、SO42﹣+2Ag+═Ag2SO4↓,所以可能含有Cl﹣、CO32﹣、SO42﹣中的至少一种;
第二份加足量KOH溶液加热后,收集到气体0.08mol,能和KOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+(Mg2+可以和OH﹣反应生产氢氧化镁沉淀),故可确定一定含有NH4+,一定不存在Mg2+。根据反应NH4++OH﹣![]() NH3↑+H2O,产生NH3为0.08mol,可得NH4+也为0.08mol;
NH3↑+H2O,产生NH3为0.08mol,可得NH4+也为0.08mol;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g,部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32﹣+Ba2+═BaCO3↓、SO42﹣+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解,因此溶液中一定存在CO32﹣、SO42﹣,一定不存在Ba2+;由条件可知BaSO4为4.66g,物质的量为0.02mol,SO32﹣物质的量浓度为:![]() =0.2mol/L,BaCO3为12.54g﹣4.66g═7.88g,物质的量为0.04mol,则CO32﹣物质的量为0.04mol,CO32﹣物质的量浓度为
=0.2mol/L,BaCO3为12.54g﹣4.66g═7.88g,物质的量为0.04mol,则CO32﹣物质的量为0.04mol,CO32﹣物质的量浓度为![]() =0.4mol/L;
=0.4mol/L;
由上述分析可得,溶液中一定存在CO32﹣、SO42﹣、NH4+,一定不存在Mg2+、Ba2+.而CO32﹣、SO42﹣、NH4+物质的量分别为0.04mol、0.02mol、0.08mol,CO32﹣、SO42﹣所带负电荷分别为0.04mol×2、0.02mol×2,共0.12mol,NH4+所带正电荷为0.08mol,所以一定含有钠离子,钠离子的物质的量最小是0.04mol,氯离子不能确定。
A. 由分析可知Na+一定存在,故A正确;
B. 100mL溶液中含0.04mol碳酸根离子,故B错误;
C. 氯离子是否存在无法确定,故C错误;
D. Mg2+、Ba2+一定不存在,故D错误;
正确答案是A。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极![]() 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加![]() 据此回答问题:
据此回答问题:
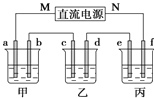
(1)电源的M端为_____________极;
(2)电极d上发生的电极反应式为__________; 乙池溶液PH__________填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________;
(5)若利用丙池实现铁上镀铜,则“e-f-x”![]() 溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯![]() 结构式为
结构式为![]() 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由![]() 和
和![]() 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为![]() 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
化学键 |
|
|
|
|
键能 | 243 | a | 607 | 630 |
当![]() 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol·L-1、0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol·L-1)是( )
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CuO![]() 2Cu2O+O2↑,关于该反应的叙述不正确的是
2Cu2O+O2↑,关于该反应的叙述不正确的是
A. 固体的颜色由黑色变为红色
B. 铜元素被还原,氧元素部分被氧化
C. 16 g氧化铜分解时转移电子0.2 mol
D. 可说明热稳定性:氧化铜>氧化亚铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
(査阅资料)①Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成KClO3;②K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。
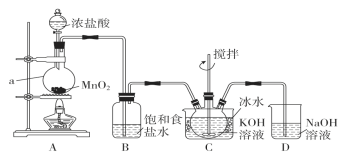
(1)仪器a的名称是________;装置A中反应的化学方程式为_______________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是______________________。
(3)装置B吸收的气体是________,装置D的作用是____________。
(4)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25 ℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为____________________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0~5 ℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.![]()
II.![]()
(1)则![]() 的△H= ________(用△H1、△H2表示)
的△H= ________(用△H1、△H2表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(3)在恒容密闭容器中发生反应I:

①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=________,反应I的平衡常数K=________。
②反应II中CH3OH的转化率α=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:

下列有关物质的推断不正确的是( )
A. 若甲为焦炭,则丁可能是O2B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5gZn放入足量的盐酸中,锌完全反应。计算:
(1)6.5gZn的物质的量?_________。
(2)参加反应的HCl的物质的量?_________。
(3)生成氢气的体积(标准状况)?__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com