
【题目】室温下,用相同浓度的NaOH溶液,分别滴定相同体积、浓度均为0.l mol·L-1的三种弱酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是
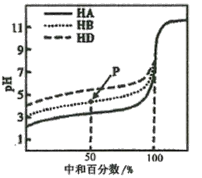
A.室温下,同浓度的NaA、NaB、NaD溶液的pH大小关系:pH(NaA)>pH(NaB)>PH(NaD)
B.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
【答案】C
【解析】
浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,酸越弱,电离出的H+越少,起始时pH值越大,根据图象,则三种酸的强弱为:HA>HB>HD。
A、浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,酸越弱,电离出的H+越少,起始时pH值越大,根据图象,则三种酸的强弱为:HA>HB>HD,酸越强,电离出的H+越多,对水的抑制作用越大,则三种溶液中,由水电离产生的c(H+)的关系为:HA<HB<HD,故A错误;
B、滴定至P点时,此时中和百分数为50%,对于HB溶液,此时溶液中的起始组分为c(HB):c(NaB)=1:1,显酸性,则c(H+)>c(OH-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(B-),由于c(H+)>c(OH-),则c(B-)>c(Na+),考虑到溶液显酸性,则以HB的电离为主导,但始终是微弱的,而HB的电离又会抑制水的电离,因此c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C、pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,对于HA溶液,c(Na+)=c(A-),对于HB溶液,c(Na+)=c(B-),对于HD溶液,c(Na+)=c(D-),由图可知,中和到相同pH时,中和分数HA>HB>HD,即加入氢氧化钠的量HA>HB>HD,则三种溶液中:c(A-)>c(B-)>c(D-),故C正确;
D、当中和百分数达100%时,三种溶液分别恰好存在等量的NaA、NaB、NaD,三种溶液混合,则起始时c(NaA):c(NaB):c(NaD)=1:1:1,根据质子守恒,c(HA)+ c(HB)+ c(HD)+c(H+)=c(OH- ),则有c(HA)+ c(HB)+ c(HD)=c(OH-)-c(H+),故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】对于可逆反应H2(g)+I2(g)![]() 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.压强不变时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组研究钠的燃烧反应产物,取金属钠(表面已被氧化),吸干煤油,置于坩埚内,上方倒扣盛满O2集气瓶,加热一段时间,充分反应后观察到产物为白色固体和淡黄色固体的混合物,测得反应前后各物质的质量如下表:
质量/g | ||
反应前 | 坩埚 | 100 |
盛有金属钠的坩埚 | 105.4 | |
反应后 | 盛有固体产物的坩埚 | 107.4 |
请回答下列问题:
(1)根据实验现象,推测固体产物成分为___________________(填化学式)
(2)将产物全部溶于水,观察到有气泡生成,写出该反应的化学方程式为________。
(3)测得上述溶液中n(Na+)=0.2mol,通过计算证实加热过程中存在表面的Na2O转化为Na2O2。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置模拟制备碳酸镧。
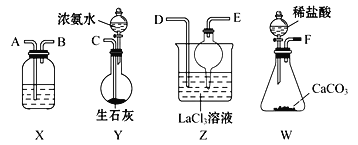
(1)盛放稀盐酸的仪器名称为________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为F→____→____→____→____→______。
(3)W中发生反应的离子方程式为_______Y中发生反应的化学反应方程式为__________
(4)X中盛放的试剂是_________,干燥管的作用为_________________。
(5)Z中通入气体的方式________
A.先通入足量NH3,后通入过量的CO2
B.先通入足量CO2,后通入过量的NH3
C.NH3和CO2同时通入
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为________________,实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,则关于两种物质稳定性实验结论为_____。
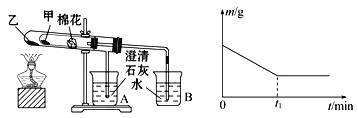
A.稳定性La2(CO3)3>La(HCO3)3
B.稳定性La2(CO3)3<La(HCO3)3
C.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时己知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。

下列说法不正确的是
A.元素甲比Al的最高价氧化物的水化物的碱性弱B.原子半径比较:甲>乙>Si
C.元素乙位于现行元素周期表第四周期第ⅣA族D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在474.8g水中溶解25.2g草酸晶体(H2C2O4·2H2O,相对分子质量为126),得到一份草酸浓溶液,该溶液密度为2.0g/cm3。
(1)以上过程得到的草酸浓溶液的物质的量浓度为___mol/L。
(2)现需用上述浓溶液配制0.1mol/L的草酸溶液450mL。
①实验中用到的玻璃仪器有胶头滴管、烧杯、量筒、___。
②应量取浓溶液的体积为___mL。
③下列情况中,会导致配制的0.1mol/L的草酸溶液浓度偏高的有___(填字母)。
A.配制浓溶液所使用的草酸晶体失去部分结晶水
B.使用“左码右物”的方法称量草酸晶体
C.容量瓶未经干燥就使用
D.量取浓溶液时仰视刻度线
(3)H2C2O4·2H2O受热易分解,分解产物均为氧化物,其中一种产物能使澄清石灰水变浑浊,请写出H2C2O4·2H2O受热分解的化学方程式___。
(4)用移液管量取10.00mL酸性K2Cr2O7溶液,恰好与20.00mL0.1mol/L的草酸溶液反应,还原产物为Cr3+,氧化产物为CO2。在此实验中,草酸体现___性;此酸性K2Cr2O7溶液的物质的量浓度为___mol/L(保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼,能使绦虫瘫痪。某学生设计了以X为原料的合成路线如下:
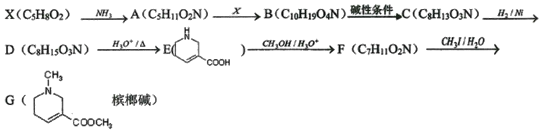
己知:①X能使溴水褪色、能水解,水解产物之一为乙醇。
②
③![]()
(1)槟榔碱中非氮官能团的名称__________,C的结构简式____________。
(2)下列说法正确的是_____________。
A.化合物A能形成内盐
B.化合物C的1H-NMR谱表明含6组峰
C.化合物D有碱性
D.化合物E能溶于水
E.化合物F在一定条件下能发生加聚、氧化、取代等反应
(3)D→E反应的方程式____________。
(4)烟酸![]() 也可以合成槟榔碱。写出烟酸的同分异构体,且符合下列条件的结构简式________。
也可以合成槟榔碱。写出烟酸的同分异构体,且符合下列条件的结构简式________。
①1H-NMR谱表明分子中有3种氢原子
②只含有一个六元环,环上无氧原子,且只有1个取代基
(5)结合题给信息,请设计由乙醇和E![]() 为原料合成化合物M
为原料合成化合物M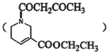 的路线,(用流程图表示,试剂任选)__________________________。
的路线,(用流程图表示,试剂任选)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计将废金属合金(只含铝、铁、铜)回收再利用制备胆矾、氯化铝晶体和聚合硫酸铁[Fe2(OH)n(SO4)3n/2]m的流程如下图所示,则下列有关叙述中不正确的是( )
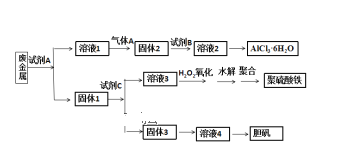
A.本实验中试剂A为氢氧化钠溶液,试剂B盐酸,试剂C为稀硫酸
B.过量气体A与溶液1的反应的离子方程式为:2AlO2- + CO2 + 3H2O = 2Al(OH) 3↓+ CO32-
C.固体3生成溶液4,可能为反应为:2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O
D.溶液3与H2O2反应的化学方程式为:2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),该反应的化学方程式为________;若反应中有0.3mol电子发生转移时,生成亚硝酸的质量为_______g (保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com