
【题目】学习小组研究钠的燃烧反应产物,取金属钠(表面已被氧化),吸干煤油,置于坩埚内,上方倒扣盛满O2集气瓶,加热一段时间,充分反应后观察到产物为白色固体和淡黄色固体的混合物,测得反应前后各物质的质量如下表:
质量/g | ||
反应前 | 坩埚 | 100 |
盛有金属钠的坩埚 | 105.4 | |
反应后 | 盛有固体产物的坩埚 | 107.4 |
请回答下列问题:
(1)根据实验现象,推测固体产物成分为___________________(填化学式)
(2)将产物全部溶于水,观察到有气泡生成,写出该反应的化学方程式为________。
(3)测得上述溶液中n(Na+)=0.2mol,通过计算证实加热过程中存在表面的Na2O转化为Na2O2。___________________
【答案】Na2O、Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 由表中数据可知,反应前![]() =0.235mol>0.2mol,反应前为Na、Na2O的混合物,设物质的量分别为x、y,则23x+62y=5.4,x+2y=0.2,解得x=0.1mol、y=0.05mol,则Na、Na2O的质量分别为2.3g、3.1g,如只有Na加热生成Na2O2,生成的质量Na2O2为0.05mol×78g/mol=3.9g,100g+3.1g+3.9g=107g<107.4g,说明加热过程中存在表面的Na2O转化为Na2O2
=0.235mol>0.2mol,反应前为Na、Na2O的混合物,设物质的量分别为x、y,则23x+62y=5.4,x+2y=0.2,解得x=0.1mol、y=0.05mol,则Na、Na2O的质量分别为2.3g、3.1g,如只有Na加热生成Na2O2,生成的质量Na2O2为0.05mol×78g/mol=3.9g,100g+3.1g+3.9g=107g<107.4g,说明加热过程中存在表面的Na2O转化为Na2O2
【解析】
(1)根据观察到固体产物为白色固体和淡黄色固体确定物质的成分;
(2)Na2O2与水反应生成氧气,产生气泡;
(3)假设反应前固体完全为Na,计算其物质的量并与0.2mol进行比较判断固体的成分,然后设物质的量分别为x、y,则23x+62y=5.4,x+2y=0.2,解得x=0.1mol、y=0.05mol,确定固体中含有Na、Na2O的质量分别为2.3g、3.1g,再用极端法进行计算,若其中Na完全转化为Na2O2时产物的质量与坩埚的质量合并与107.4g进行比较,判断Na2O是否被氧化为Na2O2,以此来解答。
(1)观察到产物为白色固体和淡黄色固体,则可确定产物为Na2O、Na2O2;
(2)Na2O2与水反应生成氧气,因此会观察到产生气泡,反应方程式为2Na2O2+2H2O=4NaOH+O2↑;
(3)根据表中数据可知,若反应前的固体物质完全是Na,其物质的量![]() =0.235mol>0.2mol,说明反应前固体为Na、Na2O的混合物,设混合物中Na、Na2O物质的量分别为x、y,则23x+62y=5.4,x+2y=0.2,解得x=0.1mol、y=0.05mol,则m(Na)=0.1mol×23g/mol=2.3g;m(Na2O)=0.05mol×62g/mol=3.1g。如只有Na加热生成Na2O2,则其生成的质量Na2O2的质量m(Na2O2)=0.05mol×78g/mol=3.9g,可知100g+3.1g+3.9g=107g<107.4g,说明加热过程中也存在表面的Na2O转化为Na2O2。
=0.235mol>0.2mol,说明反应前固体为Na、Na2O的混合物,设混合物中Na、Na2O物质的量分别为x、y,则23x+62y=5.4,x+2y=0.2,解得x=0.1mol、y=0.05mol,则m(Na)=0.1mol×23g/mol=2.3g;m(Na2O)=0.05mol×62g/mol=3.1g。如只有Na加热生成Na2O2,则其生成的质量Na2O2的质量m(Na2O2)=0.05mol×78g/mol=3.9g,可知100g+3.1g+3.9g=107g<107.4g,说明加热过程中也存在表面的Na2O转化为Na2O2。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】常温下,在下列各组指定溶液中一定不能大量共存的离子组的个数是( )
①强酸性溶液中:Mg2+、K+、![]() 、
、![]()
②强碱性溶液中:Na+、Ba2+、![]() 、
、![]()
③在无色溶液中:H+、K+、![]() 、F-
、F-
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、![]() 、Cl-
、Cl-
⑤无色透明溶液中:![]() 、K+、Cl-、
、K+、Cl-、![]()
⑥无色透明的碱性溶液中:Na+、Ba2+、Cl-、![]()
A.一个B.两个C.三个D.四个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
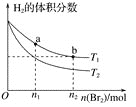
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达正确的是( )
A.羟基的电子式:![]()
B.乙烯结构简式:CH2CH2
C.R2+离子核外有a个电子,b个中子,R原子表示为:![]() R
R
D.NaClO的电离方程式:NaClO=Na++Cl-+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是
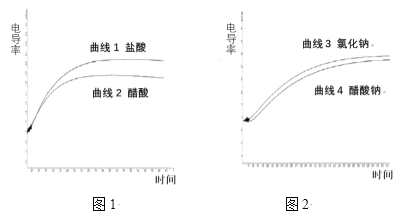
A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①NaHCO3;②C2H5OH;③Cu;④H2O;⑤石灰乳;⑥CO;⑦Ba(OH)2;⑧盐酸;⑨H2CO3;⑩浓硝酸。
(1)属于电解质的是___(填写序号),属于非电解质的是___(填写序号)。
(2)⑨在水溶液中的电离方程式为___。
(3)⑤与⑧反应的离子方程式为___。
(4)向⑦的溶液中滴加①的溶液至Ba2+恰好完全沉淀,离子方程式为___。
(5)③与⑩反应的离子方程式如下,请配平方程式(在中填入系数,在横线上写上缺少的物质),并用“单线桥”标出电子转移的方向与数目。___
Cu+NO3-+ —Cu2++NO2↑+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定相同体积、浓度均为0.l mol·L-1的三种弱酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是
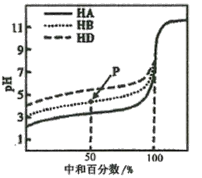
A.室温下,同浓度的NaA、NaB、NaD溶液的pH大小关系:pH(NaA)>pH(NaB)>PH(NaD)
B.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是
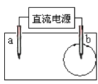
A.a电极与电源的正极相连接
B.b电极是阴极
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com