
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是
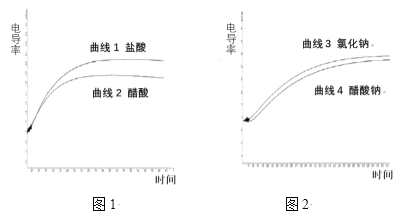
A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
【答案】D
【解析】
A.曲线1中盐酸溶液在升高温度的过程中离子浓度不变,但电导率逐渐升高,说明温度升高可以提高离子的迁移速率,故A正确;
B.温度升高,促进CH3COONa溶液中CH3COO-的水解,则由曲线3和曲线4可知,温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关,故B正确;
C.曲线1和曲线2起始时导电率相等,但温度升高能促进醋酸的电离,溶液中离子浓度增加,但盐酸溶液的导电率明显比醋酸高,说明可能原因是Cl-的迁移速率大于CH3COO-的迁移速率,故C正确;
D.曲线1和曲线2起始时导电率相等,可知盐酸和醋酸两溶液中起始时离子浓度相等,包括H+和OH-浓度也相等,而随着温度的升高,促进醋酸的电离,醋酸溶液中的H+和OH-浓度不再和盐酸溶液的H+和OH-浓度相等,则两者的导电率升高的幅度存在差异,可能与溶液中H+、OH-的浓度和迁移速率有关,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】VL浓度为0.5mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2VL
B.将溶液加热浓缩到0.5VL
C.加入10mol.L-1的盐酸0.1VL,再稀释至1.5VL
D.加入VL1.5mol.L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,氯水中部分含氯的物质的量浓度分数(某物质的物质的量浓度占各物质的量浓度之和的百分数)与pH的关系如图所示。下列叙述正确的是( )

A.pH=1的新制氯水中,c(Cl2)>c(ClO-)>c(HClO)
B.随着pH增大,溶液颜色不断加深
C.pH>10时,溶液中含氯微粒主要为ClO-和Cl-
D.pH=4的氯水中加入NaOH溶液,只发生离子反应HClO+OH-=ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
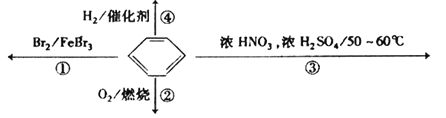
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组研究钠的燃烧反应产物,取金属钠(表面已被氧化),吸干煤油,置于坩埚内,上方倒扣盛满O2集气瓶,加热一段时间,充分反应后观察到产物为白色固体和淡黄色固体的混合物,测得反应前后各物质的质量如下表:
质量/g | ||
反应前 | 坩埚 | 100 |
盛有金属钠的坩埚 | 105.4 | |
反应后 | 盛有固体产物的坩埚 | 107.4 |
请回答下列问题:
(1)根据实验现象,推测固体产物成分为___________________(填化学式)
(2)将产物全部溶于水,观察到有气泡生成,写出该反应的化学方程式为________。
(3)测得上述溶液中n(Na+)=0.2mol,通过计算证实加热过程中存在表面的Na2O转化为Na2O2。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL则该R摩尔质量为___。
(2)已知CO、SO2的混合气体质量共18.4g,标准状况下体积为8.96L,则可推知该混合气体中CO的物质的量分数为____,混合气体的平均相对分子质量为____。
(3)同温同压下,SO2与氢气的密度之比为____;若体积相同时,两种气体的质量比为____。
(4)质量比为51∶28的NH3、CO所含质子数之比为____。
(5)标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置模拟制备碳酸镧。
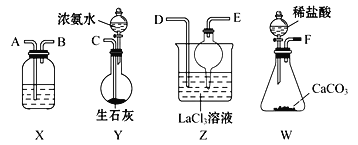
(1)盛放稀盐酸的仪器名称为________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为F→____→____→____→____→______。
(3)W中发生反应的离子方程式为_______Y中发生反应的化学反应方程式为__________
(4)X中盛放的试剂是_________,干燥管的作用为_________________。
(5)Z中通入气体的方式________
A.先通入足量NH3,后通入过量的CO2
B.先通入足量CO2,后通入过量的NH3
C.NH3和CO2同时通入
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为________________,实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,则关于两种物质稳定性实验结论为_____。
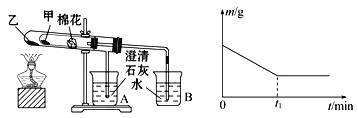
A.稳定性La2(CO3)3>La(HCO3)3
B.稳定性La2(CO3)3<La(HCO3)3
C.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在474.8g水中溶解25.2g草酸晶体(H2C2O4·2H2O,相对分子质量为126),得到一份草酸浓溶液,该溶液密度为2.0g/cm3。
(1)以上过程得到的草酸浓溶液的物质的量浓度为___mol/L。
(2)现需用上述浓溶液配制0.1mol/L的草酸溶液450mL。
①实验中用到的玻璃仪器有胶头滴管、烧杯、量筒、___。
②应量取浓溶液的体积为___mL。
③下列情况中,会导致配制的0.1mol/L的草酸溶液浓度偏高的有___(填字母)。
A.配制浓溶液所使用的草酸晶体失去部分结晶水
B.使用“左码右物”的方法称量草酸晶体
C.容量瓶未经干燥就使用
D.量取浓溶液时仰视刻度线
(3)H2C2O4·2H2O受热易分解,分解产物均为氧化物,其中一种产物能使澄清石灰水变浑浊,请写出H2C2O4·2H2O受热分解的化学方程式___。
(4)用移液管量取10.00mL酸性K2Cr2O7溶液,恰好与20.00mL0.1mol/L的草酸溶液反应,还原产物为Cr3+,氧化产物为CO2。在此实验中,草酸体现___性;此酸性K2Cr2O7溶液的物质的量浓度为___mol/L(保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对C2H6和C5H12的分析错误的是( )
A. 互为同系物
B. C2H6失去1个H得到的乙基只有一种结构
C. C5H12的一氯代物可能只有一种
D. 2,2-二甲基丙烷的沸点高于其同分异构体的沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com