
【题目】用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如右图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内液面上升,气体变成无色;③滴管内液面再次下降.下列说法中错误的是( ) 
A.现象①中产生的红棕色气体为NO2
B.产生现象②的原因是NO2与水反应
C.产生现象③的原因是铜与稀硝酸反应
D.最终瓶内溶液中的溶质只有Cu(NO3)2
【答案】D
【解析】解:A.用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中,铜和浓硝酸反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,生成的二氧化氮为红棕色气体,因滴管内有气体生成,压强增大,所以,液面下降,现象①中产生的红棕色气体为NO2 , 故A正确;B.现象①中产生的二氧化氮能和水反应,N元素的化合价既升高又降低,N元素的化合价由+4升高到+5价,降低到+2价,反应为:3NO2+H2O═2HNO3+NO,从方程式可知,3mol红棕色的二氧化氮与水反应,生成1mol一氧化氮无色气体,气体体积减少,滴管内压强减少,所以滴管内液面上升,气体变成无色,故B正确;
C.现象②3NO2+H2O═2HNO3+NO,生成的硝酸与内置的螺旋状铜丝反应,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
因滴管内有气体生成,压强增大,所以,液面下降,所以产生现象③的原因是铜与稀硝酸反应,故C正确;
D.滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,现象③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的一氧化氮气体与氧气反应生成硝酸,硝酸继续与铜反应,最终可能有硝酸剩余,所以最终瓶内溶液中的溶质一定有Cu(NO3)2,可能有硝酸,故D错误;
故选:D.


科目:高中化学 来源: 题型:
【题目】能够鉴定氯乙烷中氯元素的存在的操作是( )
A.在氯乙烷中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐依次排列的是
A. 硫酸、碳酸钠、硫酸钠 B. 硫酸、烧碱、胆矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的BaCl2溶液加入到250ml碳酸钠和硫酸钠的混合溶液中,充分反应后,过滤、洗涤、干燥后得到6.27g沉淀.向沉淀中加入过量的盐酸产生气体,最后有2.33g沉淀不溶.
(1)求此硫酸钠溶液的物质的量浓度.
(2)向沉淀中加入过量的盐酸充分反应,求最终产生的气体在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3 , 试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( ) 
A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),设计了如下流程:  下列说法不正确的是( )
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中各装置的叙述不正确的是( ) 
A.装置①是中和滴定法测定硫酸的物质的量浓度
B.装置②中手捂烧瓶(橡胶管已被弹簧夹夹紧),发现导管中有液柱上升并保持稳定,则说明装置不漏气
C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸
D.装置④可检验溴乙烷发生消去反应得到的气体中含有乙烯(假定每个装置中吸收完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将可溶性碱A、盐B的溶液按如下程式进行实验,根据下述现象判断: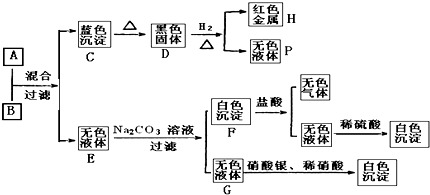
(1)A的化学式B的化学式 .
(2)完成下列转化的化学方程式,标明电子转移的方向和数目:D→H+P:
(3)写出F和盐酸反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究硝酸的性质,某同学设计并完成如下实验:室温下,将铁片分别置于适量的浓HNO3和稀HNO3中(如图所示).
(1)气球的作用是 .
(2)A中最终溶液变为浅绿色,发生反应的离子方程式是 .
(3)B中无明显变化,该同学进一步探究如下:假设:①常温下铁与浓硝酸不反应.② . 进行实验:将B中的铁片取出并洗净后,放入CuSO4溶液中,无明显变化,则说明假设①(填“成立”或“不成立”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com